
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодический закон Д. И. МенделееваСодержание книги
Поиск на нашем сайте
В состав любого вещества входят структурные элементы различной степени сложности (ядра, электроны, атомы, ионы, молекулы). Совокупность структурных элементов вещества, описываемая определенным порядком их расположения и характером взаимодействия, называется строением вещества. От строения вещества и, в первую очередь, от взаимного расположения атомов зависят физические и химические свойства вещества. При химических превращениях количество атомов разных элементов, входящих в состав вещества, не изменяется. Происходит только перегруппировка атомов, которая сопровождается перестройкой электронной структуры атомов и изменением химической связи между атомами – разрываются старые и образуются новые связи. В этом разделе рассматриваются вопросы, связанные со строением вещества, – строение атомов и химическая связь. Химические свойства атомов определяются строением их электронных оболочек, в первую очередь внешних (валентных) оболочек. Поэтому химические свойства атомов прогнозируют на основе анализа особенностей строения электронных оболочек атомов (электронных конфигураций). При изучении этой темы [1, 2, 3] обратите внимание на волновой характер движения электронов в атоме. Движение частиц в микромире описывается с помощью постулатов квантовой механики. При этом используют вероятностный подход, в рамках которого положение электрона в любой момент времени нельзя указать точно, а можно говорить только о вероятности его нахождения. Одним из ключевых понятий в теории строения атома является состояние электрона. Особенностью микромира является то, что состояние электрона в атоме не может быть произвольным. Для любого атома характерно наличие некоторого дискретного набора состояний, каждое из которых имеет свое значение энергии и описывается своей волновой функцией, зависящей от координат и времени. Волновая функция y(x, у, z, t) является решением уравнения Шредингера. Произведение |ψ|2∆ V характеризует вероятность нахождения электрона в малом объеме ∆ V. Наглядный образ, показывающий, где электрон может чаще находиться в атоме, – это так называемое «электронное облако», плотность которого пропорциональна величине |ψ|2. Для классификации состояний электрона в атоме и соответствующих волновых функций используют набор из четырех квантовых чисел. К ним относятся главное (n), орбитальное ( l ), магнитное (m) и спиновое (ms) квантовые числа. Состояние электрона однозначно определено, если известны значения всех этих чисел. Напомним, что главное квантовое число характеризует величину энергии электрона в атоме и размеры электронного облака. Оно принимает целочисленные значения n = 1, 2, 3, … ∞.Совокупность состояний с одинаковым значением главного квантового числа образует электронный слой. Соответствующая совокупность энергий называется энергетическим уровнем. Орбитальное квантовое число l характеризует механический момент электрона при его движении вокруг ядра и форму электронного облака. Численным значениям орбитального квантового числа l = 0, 1, 2, 3, …, (n–1) соответствуют следующие буквенные обозначения оболочек (или подуровней):
Заметим, что количество подуровней на уровне (количество разных значений l) определяется величиной главного квантового числа n. На первом уровне имеется только один подуровень (1 s), на втором – два (2 s и 2 p), на третьем – три, (3 s, 3 p и 3 d) и т.д. (В обозначении подуровня вначале указывают значение числа n, а затем буквенное обозначение числа l.) Магнитное квантовое число m характеризует проекцию орбитального механического момента электрона на некоторую выбранную ось, а также ориентацию электронного облака в пространстве. Магнитное квантовое число принимает значения – l, –(l– 1), … –1, 0, +1, …, (l – 1),l. При фиксированных значениях n и l имеются (2l + 1) разных значений m. Наконец, четвертой квантовой характеристикой электрона в атоме является спиновое квантовое число ms, которое характеризует проекцию собственного механического момента (спина) электрона на выбранную ось. Это число принимает только два значения: ms = ± Количество электронов, находящихся в том или ином состоянии в атоме, не может быть произвольным. Оно определяется принципом Паули, который гласит: в состоянии, описываемом четырьмя квантовыми числами n, l, m, ms, может находиться не более одного электрона. Это означает, что в определенном состоянии либо находится один электрон (тогда состояние называется заполненным), либо в нем нет ни одного электрона и состояние свободно. В химии вместо состояний электрона в атоме, описываемых четырьмя квантовыми числами, часто говорят об атомных орбиталях. Атомной орбиталью называется состояние электрона, которое описывается только тремя квантовыми числами: n, l, m, а спиновое число ms не фиксируется. В соответствии с принципом Паули, на атомной орбитали (АО) могут находиться два электрона с противоположными направлениями спинов. Обычно атомные орбитали изображают в виде клеток («квантовых» ячеек), внутри которых изображают стрелки ↑ и ↓, соответствующие различным направлениям спина. Названия конкретных атомных орбиталей определяются значениями чисел n иl(аналогично названиям подуровней). Например, 2 p -орбиталь – это состояние с n = 2 и l = 1. Значение числа m обычно не включают в название орбиталей. Но это число определяет количество разных орбиталей с одинаковыми n иl. Напомним, что количество разных значений m равно
Пример 1. Какие значения могут принимать квантовые числа для второго энергетического уровня? Решение В условии задачи задано главное квантовое число n = 2. Диапазон изменения остальных квантовых чисел определяетсяэтим числом. Известно, что орбитальное квантовое число lпринимает значения 0, 1, 2, …, (n – 1). Таким образом, на уровне с n = 2 имеются орбитали с l = 0 и l = 1, то есть на втором энергетическом уровне есть s и р -подуровни. Магнитное квантовое число изменяется в пределах от –l до +l. В соответствии с принципом Паули, каждый электрон имеет в атоме единственный набор из четырех квантовых чисел. Указанную взаимосвязь квантовых чисел можно представить в виде таблицы:
Из данной таблицы видно, что второй энергетический уровень содержит s -подуровень (одна орбиталь) и p -подуровень (три орбитали). На каждой орбитали размещаются по два электрона, отличающихся значением спинового числа. Последовательно суммируя количество электронов на подуровнях, находим, что максимальное количество электронов на втором уровне равно 8. Заполнение орбиталей в атомах происходит в соответствии с принципом минимума энергии. Известно, что основной запас энергии электрона в атоме определяется значением главного квантового числа n. Орбитальное квантовое числоlтакже влияет на величину энергии в многоэлектронных атомах, оно характеризует способность электрона проникать к ядру при наличии других электронов. Легче всего проникают к ядру и сильнее с ним взаимодействуют s -электроны, затем p-, d-, f - (и т. д.) электроны. Поэтому энергия электрона на атомных орбиталях возрастает в ряду s, p, d, f. Последовательность заполнения уровней и подуровней в атомах определяется правилами Клечковского: заполнение подуровней происходит последовательно с увеличением суммы (n + l ), а при одинаковом значении этой суммы вначале заполняется уровень с меньшим значением n. В соответствии с правилами Клечковского, последовательность энергетических подуровней в атоме может быть представлена рядом:
E (1 s) < E (2 s) < E (2 p) < E (3 s) < E (3 p) < E (4 s) < < E (3 d) < E (4 p) < E (5 s) < E (4 d) < E (5 p) < E (6 s) … (5.1)
Распределение электронов по энергетическим уровням, подуровням и орбиталям описывают с помощью электронных формул атомов. Надстрочные индексы в формуле указывают число электронов, находящихся на подуровне. Общее количество электронов в атоме зависит от порядкового номера элемента в периодической системе, то есть от заряда ядра. Например, порядковый номер атома алюминия равен 13. С учетом емкости и последовательности энергетических подуровней (5.1) электронная формула алюминия имеет вид: 13Al 1 s 22 s 22 p 63 s 23 p 1. Сумма надстрочных индексов здесь равна 13. Пример 2. Постройте электронную формулу атома титана (Z = 22),используя взаимосвязь между квантовыми числами, а также правила Клечковского. Решение В атоме титана на электронных оболочках распределены 22 электрона. В первом квантовом слое с n = 1 имеется только 1 s -оболочка, емкость которой равна 2 (электронная конфигурация этой оболочки – 1 s2). Затем заполняется второй слой, состоящий из двух оболочек, 2 s и 2 p. Последовательность заполнения этих оболочек определяется по правилу Клечковского:
(n + l)2 s = 2 + 0 = 2 и (n + l)2 p = 2 + 1 = 3, поэтому заполнение оболочек происходит от 2 s к 2 p, то есть. 2 s2 2 p6. Таким образом, в двух электронных слоях размещается 10 электронов (1 s2, 2 s2, 2 p6). Далее заполняется третий слой: n = 3 (3 s, 3 p, 3 d). Для этих оболочек сумма (n + l) составляет (n +l)3 s = 3 + 0 = 3, (n + l)3 p = 3 + 1 = 4, и, наконец, (n + l)3 d = 3 + 2 = 5. Значит, заполнение оболочек должно происходить в направлении 3 s → 3 d. Более точный анализ заполнения подоболочек должен учитывать предыдущие и последующие квантовые слои. Сумма (n + l) для 2 р -оболочки и 3 s -оболочки одинакова. В соответствии со вторым правилом Клечковского при одинаковом значении суммы (n + l) заполнение происходит в направлении возрастания главного квантового числа: 2 p → 3 s. Последующий квантовый слой n = 4 имеет четыре квантовых оболочки: 4 s, 4 p, 4 d и 4 f. Для них суммы (n + l) равны соответственно 4, 5, 6, 7. Сумма (n + l)4 s < (n + l)3 d. Поэтому заполнение электронных оболочек происходит в такой последовательности: 3 s, 3 p, 4 s, 3 d, 4 p и т. д. Окончательная запись электронной формулы: 22Ti 1s22 s 22 p 63 s 23 p 6 4s 2 3d 2. В этой формуле сумма надстрочных индексов, как и должно быть, равна количеству электронов в атоме. Здесь подчеркнуты валентные электроны, то есть электроны внешних и недостроенных предвнешних слоев, участвующих в образовании химических связей. Внешняя часть электронной формулы атома, на которой находятся валентные электроны, называется валентной электронной конфигурацией: 22Ti [Ar] 3 d 24 s 2 или Ti … 3 d 24 s 2. С помощью электронных конфигураций можно прогнозировать основное свойство атома – валентность,ипредсказывать его химическое поведение. При изучении вопроса о последовательности заполнения подуровней в многоэлектронных атомах обратите внимание на представление об устойчивых электронных конфигурациях атомов. Как известно, наибольшей устойчивостью обладают электронные оболочки инертных газов (s 2, p 6). Квантово-механические расчеты показывают, что устойчивыми являются полностью заполненные электронами оболочки s2, p 6, d 10, f 14. Относительной устойчивостью обладают наполовину заполненные оболочки, то есть s 1, p 3, d 5, f 7. Обратите внимание на правило Гунда, согласно которому в пределах подуровня электроны стремятся занять состояния так, чтобы суммарный спин был максимальным, то есть стремятся занять максимальное количество свободных орбиталей. Это обеспечивает максимальное значение суммарного спина электронов. Опытные данные показывают, что подуровни ns, (n – 1) d, (n – 2) f имеют близкие энергии. При их заполнении наблюдается конкуренция, обусловленная необходимостью создания энергетически устойчивой электронной оболочки. У ряда атомов наблюдается «проскок» («провал») электрона с внешнего уровня на внутренний, в результате чего электронные оболочки атомов обретают устойчивость (элементы групп IВ, VIВ и др.). Электронные формулы атомов позволяют сделать вывод о сравнительном сходстве и различии элементов и являются квантово-механической основой учения о периодичности свойств атомов. Наибольшую химическую информацию несут электронные структуры атомов (электронные конфигурации) – распределение электронов по энергетическим ячейкам.
Пример 3. Напишите электронные конфигурации атомов железа и хрома, учитывая, что в последнем случае происходит «проскок» электрона. Составьте электронные структуры атома железа и его ионов. Решение При написании электронных конфигураций вначале находим порядковые номера атомов: 26Fe и 24Cr. Атомы находятся в 4-м периоде. Из (5.1) следует, что подуровень 4 s заполняется раньше, чем 3 d. Обычно электронную конфигурацию записывают в порядке заполнения подуровней: 26Fe 1 s 22 s 22 p 63 s 23 p 64 s 23 d 6. Аналогично записывается «нормальная» электронная конфигурация атома хрома: 24Cr 1 s 22 s 22 p 63 s 23 p 6 4s 2 3d 4. Электронная оболочка 3d4 близка к устойчивой (d5). Поэтому электронная конфигурация атома Cr с учетом минимизации энергии («проскока электрона») имеет вид: 24Cr 1 s 22 s 22 p 63 s 23 p 6 4s 1 3d 5. Теперь перейдем к рассмотрению валентной электронной структуры атома железа. Валентная оболочка атома железа заполнена следующим образом: Fe … 4 s 23 d 6. Энергетические подуровни 4 s и 3 d символически обозначаются одной s - и пятью d -орбиталями. В соответствии с рядом (5.1) 4 s -подуровень заполняетcя раньше, чем 3 d, поэтому подуровень 4 s располагается ниже, чем 3 d и 4 p:
В соответствии с принципом Паули на 4 s -подуровне размещаются два электрона с противоположными спинами. На 3 d -подуровне шесть электронов распределены по правилу Гунда. Здесь неспаренными остаются четыре электрона. Нетрудно записать электронную конфигурацию различных ионов железа, например: Fe … 3 d 64 s 2, Fe+2… 3 d 54 s 1, Fe+3… 3 d 54 s 0.
Тогда электронная структура иона Fe+3 имеет вид:
Электронные конфигурации атомов позволяют объяснить периодичность изменения свойств атомов, проявляющихся при их взаимодействии. Периодическая повторяемость свойств атомов по мере роста заряда ядра обусловлена периодической повторяемостью строения внешних электронных оболочек. Напомним современную формулировку периодического закона: свойства простых веществ, а также свойства их соединений находятся в периодической зависимости от заряда ядра атома. Графическое отображение периодического закона – периодическая система Д.И. Менделеева. Положение элемента в периодической системе определяется порядковым номером или двумя координатами – номером периода и номером группы. Группы образуют главную (А) и побочную (В) подгруппы. Напомним, что координаты элемента в периодической системе определяют его основные химические свойства: в рамках одного периода с ростом заряда ядра металлические свойства элемента ослабевают и нарастают неметаллические свойства, а в рамках одной группы с ростом числа электронных слоев (номера периода) металлические свойства увеличиваются, соответственно изменяются кислотно-основные свойства оксидов и гидроксидов, а также окислительно-восстановительные свойства атомов и их соединений.
Пример 4. По координатам элемента (4, VА) определите заряд ядра его атома, электронную формулу, валентную конфигурацию атома и его ионов в высшей и низшей степенях окисления. Решение Заданные координаты означают, что элемент находится в VА -группе и 4 периоде системы. По этим координатам находим заряд его ядра Z = 33, равный порядковому номеру элемента As. Элемент находится в главной подгруппе, это указывает на неметаллический характер многих из его соединений и, в частности, кислотный характер его оксида и гидроксида. В соответствии с последовательностью (5.1) тридцать три электрона атома мышьяка размещаются следующим образом: 33As 1 s 22 s 22 p 63 s 23 p 64 s 23 d 104 p 3.
Поскольку 3 d -подуровень является внутренним и заполнен полностью, то справедлива и другая форма записи: 33As 1 s 22 s 22 p 63 s 23 p 63 d 10 4 s 24 p 3. Здесь подчеркнута валентная конфигурация атома. В образовании химических связей участвуют электроны внешних и незастроенных предвнешних оболочек. Поэтому часто записывают сокращенные электронные формулы – конфигурации атомов: 33As [Ar] 3 d 104 s 24 p 3 или 33As … 4 s 24 p 3.
В первой записи подчеркивается, что внутренние оболочки построены так же, как у предшествующего инертного газа [Ar]. В последней сокращенной формуле (конфигурации) выделены только валентные электроны. Для них обычно и строится электронная структура:
Обратите внимание, что распределение электронов на 4 p -подуровне произведено в соответствии с правилом Гунда. Высшие и низшие степени окисления атомов обычно возможны при таком распределении электронов, когда атом приобретает устойчивую электронную оболочку. Высшая положительная степень окисления As проявляется тогда, когда от атома оттягиваются все внешние электроны: As0 – 5ē = As+5.
Этому процессу соответствует перестройка внешней оболочки атома: 4 s 24 p 3 – 5ē = 4 s 04 p 0.
Электронная структура возникшего при этом иона имеет вид:
Образуемые этим элементом оксид As+52O–23 и гидроксид H+3As+5O–24 имеют кислотный характер. Аналогично, для отрицательной степени окисления превращение оболочки в устойчивую может быть записано так: 4 s 24 p 3 + 3ē = 4 s 24 p 6.
Отрицательная степень окисления проявляется при взаимодействии с электроположительными атомами, например, в As–3H+13.
Анализ большого фактического материала о свойствах элементов позволяет сгруппировать элементы по типу застраиваемой оболочки в s-, p-, d-, f- элементы, которые образуют соответствующие электронные семейства. Для каждого электронного семейства характерен определенный набор свойств. Таблица периодической системы может рассматриваться как своеобразная матрица физико-химических свойств атомов. При изучении этого вопроса обратите внимание на то, что по положению элемента в периодической системе можно прогнозировать физические и химические свойства атомов и их соединений (преобладание металлических или неметаллических свойств, валентность, кислотно-оснóвный характер оксидов и гидроксидов, окислительно-восстановительные свойства соединений и т. д.). Важными количественными характеристиками свойств атомов являются радиусы их атомов R, потенциалы ионизации I, сродство к электрону E и электроотрицательность ЭО. Они тесно связаны со значением главного квантового числа. Указанные характеристики необходимо внимательно изучить по учебникам [1, 2]. Обратите внимание на характер изменения этих величин в периодической системе в пределах групп и периодов. В частности, при изучении закономерностей изменения атомных радиусов необходимо обратить внимание на различие ковалентных и орбитальных радиусов. Ковалентный радиус – это размер области, приходящейся на один атом в кристаллической решетке с ковалентной связью. Его величина зависит от конкретного вещества. Орбитальный радиус – это радиус главного максимума радиальной электронной плотности. Его значение лишь отчасти определяет размеры области нахождения электрона. Размеры атомов характеризуют способность электронов к перераспределению, то есть окислительно-восстановительные свойства. Количественной мерой этих свойств являются энергия ионизации и сродство к электрону. При изучении вопроса об электроотрицательности атомов обратите внимание на физический смысл этого понятия, существование нескольких шкал электроотрицательностей. В частности, по одной из них электроотрицательность вычисляется так:
Закономерности изменения количественных характеристик свойств атомов тесно связаны со строением их электронных оболочек. В частности, сопоставляя табличные данные, нетрудно обнаружить, что относительные экстремумы свойств приходятся на устойчивые электронные конфигурации.
Пример 5. Рассмотрите закономерность изменения сродства к электрону для элементов с Z = 49 – 54 и на основании электронных конфигураций объясните особенности поведения данных элементов. Решение Представим величины сродства к электрону, а также электронные конфигурации валентных орбиталей атомов в виде таблицы:
Известно, что сродство к электрону характеризует энергию, выделяемую при присоединении электрона к нейтральному атому. Из таблицы видно, что в рамках одного периода с ростом заряда ядра сродство к электрону в целом возрастает. Это объясняется сжатием электронных оболочек (уменьшением атомных радиусов) при росте заряда ядра. Построим график зависимости сродства к электрону от заряда ядра атома.
На кривой имеются два относительных минимума (Sb, Xe), которые соответствуют устойчивым электронным конфигурациям (p 3 и p 6). Такие устойчивые электронные оболочки с трудом присоединяют электроны. Например, электроотрицательность E
Задачи 111–114 Укажите значения четырех квантовых чисел для всех электронов внешней оболочки следующих атомов: 111) лития (1 электрон) и фтора (7 электронов); 112) бериллия (2 электрона) и кислорода (6 электронов); 113) бора (3 электрона) и серы (6 электронов); 114) углерода (4 электрона) и неона (8 электронов). 115–117 Составьте таблицу значений квантовых чисел (см. пример 1) для электронных слоев, характеризуемых: 115) n = 3; 116) n = 4; 117) n = 5. На основании принципа Паули укажите, сколько электронов может быть размещено на подуровнях этого уровня. 118–121 Из приведенных электронных конфигураций выберите те, которые практически существовать не могут. Объясните причины этого. 118) 1 p 2, 2 s 2, 2 p 7, 3 d 1, 3 f 7, 4 p 5, 5 s3, 3 d 10. 119) 1 s 2, 1 p 4, 2 d 10, 2 p 7, 3 d 5, 3 f 5, 4 p 6, 5 d 4. 120) 1 s 2, 2 d 5, 3 s 2, 3 f 5, 4 p 7, 5 d 2, 5 s 3, 5 p 4. 121 1 p 6, 2 s 2, 2 d 2, 2 p 7, 3 p 3, 3 f 4, 4 f 16, 4 p 6. 122–123 По электронным конфигурациям ионов определите заряд ядер их атомов. Запишите электронные формулы атомов и электронные структуры их внешних оболочек. 122) Э–3 [Ar 3 d 10] 4 s 2 4 p 6; Э 123) Э–2 [Ne] 3 s 2 3 p 6; Э+3 [Ar] 3 d 10. 124 Постройте график зависимости орбитального радиуса атомов элементов второго периода от заряда ядра атома (табл. 5.1). Запишите формулу оксидов и гидроксидов этих элементов. Как изменяются их свойства в зависимости от орбитального радиуса s - и p -электронов 2-го периода? Ответ мотивируйте, используя данные табл. 5.1. 125 Какой из атомов в следующих пáрах элементов имеет бóльший ионизационный потенциал: а) 1 s 22 s 22 p 63 s 23 p 2 и 1 s 22 s 22 p 63 s 23 p 5; б) 1 s 22 s 22 p 63 s 23 p 64 s 1 и 1 s 22 s 22 p 63 s 23 p 23 d 104 s 1? Дайте мотивированный ответ, учитывая взаимодействие электронов. Таблица 5.1 Орбитальные радиусы R, энергия ионизации I и сродство к электрону Е для некоторых атомов
126 На основании данных табл. 5.1 для элементов IIА группы постройте графики зависимости энергии ионизации от значения главного квантового числа; энергии ионизации от значения орбитального радиуса. Объясните характер каждой зависимости. 127 Как изменяются свойства гидроксидов элемента IIА группы? Ответ мотивируйте на основании данных табл. 5.1, зная, что Be(OH) 128 Для атомов элементов IA группы по данным табл. 5.1 постройте график зависимости энергии ионизации от орбитального радиуса. Дайте истолкование графика. Каким образом изменяются восcтановительные свойства атомов в этой группе? 129 По данным табл. 5.1 для элементов второго периода постройте графики зависимости: 1) энергии ионизации; 2) сродства к электрону от заряда ядра атома. Объясните относительные экстремумы на графиках на основании особенностей строения внешних электронных оболочек атомов. 130 Какойизатомов в каждой приведенной ниже паре имеет большие размеры, энергию ионизации, электроотрицательность: а) сера и хлор; б) бор и алюминий; в) галлий и германий? Приведите электронные формулы атомов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 415; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

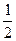 . Для графического изображения этого числа используют стрелки ↑ (ms = +
. Для графического изображения этого числа используют стрелки ↑ (ms = + 




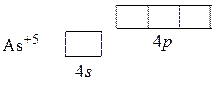
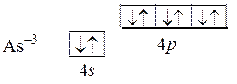
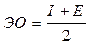 .
.
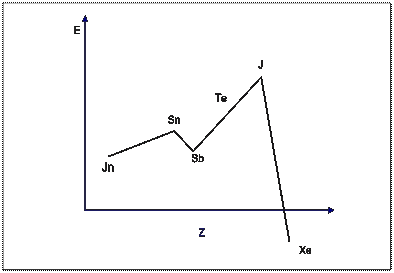
 = – 0,42 эB < 0, то есть на присоединение электрона к атому Xe необходимо затратить энергию. На кривой имеются также два относительных максимума (Sn и I). Им соответствуют электронные конфигурации s 2 p 2 и s 2 p 5, предшествующие устойчивым (p 3 и p 6), то есть при образовании устойчивых конфигураций выделяется заметное количество энергии. В рассматриваемом ряду элементов наибольшими окислительными свойствами обладает йод.
= – 0,42 эB < 0, то есть на присоединение электрона к атому Xe необходимо затратить энергию. На кривой имеются также два относительных максимума (Sn и I). Им соответствуют электронные конфигурации s 2 p 2 и s 2 p 5, предшествующие устойчивым (p 3 и p 6), то есть при образовании устойчивых конфигураций выделяется заметное количество энергии. В рассматриваемом ряду элементов наибольшими окислительными свойствами обладает йод. [Ne] 3 s 2.
[Ne] 3 s 2. обладает амфотерными свойствами.
обладает амфотерными свойствами.


