
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние катализатора на равновесиеСодержание книги
Поиск на нашем сайте
Введение катализатора в равновесную систему не изменяет положение химического равновесия, так как катализатор в одинаковой мере увеличивает скорость прямой и обратной реакций. Однако роль катализаторов при проведении обратимых реакций очень высока. При низких температурах в силу малых скоростей прямой и обратной реакций, равновесие часто устанавливается очень медленно. Поэтому приходится ждать долгое время, чтобы добиться получения необходимых количеств продуктов реакции. Повышение температуры для этой цели не всегда приемлемо. Если реакция экзотермична, то равновесие сместится в сторону исходных веществ. Применение же катализатора позволяет ускорить наступление равновесия, не повышая температуры, и получить необходимые продукты реакции в нужном количестве.
Пример 1. Константа равновесия гомогенной системы A (Г) + B (Г) Á 2 C (Г) равна 0,5. Вычислите равновесные концентрации реагирующих веществ, если начальные концентрации равны C0А = 3 моль/л, С0В = 5 моль/л. Решение Пусть к моменту установления равновесия начальные концентрации C0А и С0В уменьшится на х молей. Так как из одного моля А и В образуется 2 моля вещества С, то ∆CС = 2 x моль/л. В начальный момент вещества С не было. Составим таблицу изменения концентраций:
В выражение константы равновесия входят равновесные концентрации веществ:
Подставив значения, получим:
Таким образом, искомые равновесные концентрации равны: СА = 3 – 1 = 2 моль/л; СВ = 5 – 1 = 4 моль/л; СС = 2∙1 = 2 моль/л.
Пример 2. В процессе синтеза аммиака N2 + 3H2 Á 2NH3 равновесие установилось при следующих концентрациях веществ (моль/л):
Решение Составляем таблицу изменения концентраций, в которую вносим из условия задачи равновесные концентрации. Определяем константу равновесия этой реакции
Поскольку в начальный момент времени аммиака не было, то в ходе реакции изменение его концентрации составило 3,6 моля. Изменение концентраций Δ С участников равновесия пропорционально коэффициентам в уравнении реакции.
Исходные концентрации азота и водорода находим путем сложения равновесных концентраций с их изменениями в ходе реакции.
Пример 3. Химическое равновесие реакции CO2 + H2 Á CO + H2O в газовой фазе установилось при следующих концентрациях реагирующих веществ (моль/л): Решение Согласно принципу Ле-Шателье, при уменьшении концентрации H2O равновесие сместилось в сторону прямой реакции, т.е. концентрации CO2 и H2 уменьшились, а концентрации CO и H2O увеличились на одинаковую величину, так как все вещества реагируют в одинаковом соотношении. Обозначим изменение концентрации всех веществ через х моль/л. После смещения равновесия новые равновесные концентрации реагирующих веществ C (моль /л) стали такими, как указано в таблице. Составляем таблицу изменения концентраций.
Константа равновесия данной реакции равна:
Подставляем новые равновесные концентрации C’ в выражение для константы равновесия Kс:.
Найдем корни этого уравнения:
Корень х1 = 22,6 мы отбрасываем, поскольку уменьшение концентрации CO2 и H2 не может быть большим, чем исходные концентрации этих веществ. Поэтому реальным будет корень x2 = 0,44 моль/л. Тогда новыми равновесными концентрациями будут:
Пример 4. Вычислите константу равновесия при Т = 298 К для реакции 2NO2(Г) Á N2O4(Г), пользуясь значениями ∆ G 0298. Решение Вычисляем
Подставляя в уравнение
Задачи 81 Константа равновесия гомогенной системы A + B Á 2 C равна 50. Вычислите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а вещества С в начале реакции не было. Ответ: СA = 0,06; CB = 0,26; Cc = 0,88. Все в моль/л.
82 Реакция протекает по уравнению: CO(Г) +Cl2(г)Á COCl2(Г). Начальные концентрации CO и Cl2 равны: (моль/л): СCO = 0,28;
Ответ: 40. 83 Реакция протекает по уравнению A (Г) + B (Г) Á C (Г) + D (Г). Исходные концентрации веществ
Ответ: 9.
84 В системе 2NO2 Á 2NO + O2 равновесная концентрация NO2 равна 0,06 моль/л, NO – равна 0,24 моль/л, O2 – равна 0,12 моль/л. Вычислите константу равновесия и исходную концентрацию NO2.
Ответ: 1,92; 0,3 моль/л.
85 Равновесная концентрация в системе N2O4 Á 2NO2 для N2O4 равна 0,02 моль/л, а для NO2 – 0,03 моль/л. Вычислите равновесные концентрации после смещения равновесия в результате увеличения давления в 3 раза.
Ответ: концентрация N2O4 равна 0,076 моль/л;
86–89 Химическое равновесие гомогенной системы A + B Á C + D установилось при концентрациях (моль/л), указанных в таблице. Затем концентрацию одного из веществ увеличили (+) или уменьшили (–) на величину, указанную в скобках. Вычислите новые равновесные концентрации веществ после смещения равновесия.
Ответы: 86) СA = 6,52; CB = 5,52; CС = 2,48; CD = 14,48. Все в моль/л; 87) СA = 0,027; CB = 0,667; CC = 0,133; CD = 0,133. Все в моль/л; 88) СA = 2,85; CB = 20,85; CC =3,15; CD = 15,15. Все в моль/л; 89) СA = 13,04; CB = 11,04; CC = 4,96; CD = 28,96. Все в моль/л.
90 Химическое равновесие реакции A (Г) Á B (Г) + C (Г) установилось при следующих концентрациях реагирующих веществ (моль/л): СA = 10,
Ответ: CA = 10,8; CB =1,2; CC = 7,2. Все в моль/л.
91 Все равновесные концентрации веществ, участвующих в реакции Ответ: [CH3COOH] = 0,011 моль/л; [C2H5OH] = 0,079 моль/л; [CH3COOC2H5] = 0,029 моль/л; [H2O] = 0,029 моль/л.
92 Равновесные концентрации веществ в системе CO + Cl2 Á COCl2 равны: [CO] =0,02; [Cl2] = 0,01; [COCl2] = 0,02 моль/л. Равновесие нарушено вследствие увеличения концентрации Cl2 на 0,003 моль/л. Вычислите новые равновесные концентрации после смещения равновесия. Ответ: [CO] = 0,0186 моль/л; [Cl2] = 0,0116 моль/л; [COCl2] = 0,0214 моль/л.
93 Равновесные концентрации веществ, участвующих в реакции Ответ: [PCl5 ] = 0,009 моль/л; [PCl3] = 0,056 моль/л; [Cl2] = 0,156 моль/л.
94 Константа равновесия гомогенной реакции A + B Á C + D равна 1,5. Начальные концентрации веществ А и В равны 5 и 6 моль/л соответственно, а концентрации веществ С и D равны нулю. Вычислите равновесные концентрации всех веществ. Ответ: CА = 2 моль/л; CВ = 3 моль/л; СС = СD = 3 моль/л.
95 Реакция синтеза аммиака протекает по уравнению Ответ: 99,7.103 Па.
96 Исходные концентрации NO и Cl в системе 2NO + Cl2 Á 2NOCl равны: Ответ: 0,022.
97 В химической реакции H2(Г) + I2(Г) Á 2HI(Г) в момент равновесия установились следующие концентрации реагирующих веществ (моль/л): Ответ:
98 Реакция протекает по уравнению 2CO2 Á 2CO+O2. Состав равновесной смеси при 2000 ˚С следующий: 85,2 % CO2, 9,9 % CO и 4,9 % O2, а общее давление в системе при этой же температуре равно 101,3 . 103 Па. Вычислите константу равновесия KP. Ответ: 66,98.
99 В состоянии равновесия системы CO2 + H2 Á CO + H2O реакционная смесь имела объемный состав: 22 % CO2. 41 % H2, 17 % CO, 20 % H2O. Вычислите KP данной реакции. Ответ: 0,38. 100–103 Вычислите константы равновесия гомогенных реакций в газовой фазе, пользуясь значениями
104 Константа равновесия реакции CO + H2O Á CO2 + H2 при 727 ˚C равна 1,4, а при 927 ˚C равна 0,78. Вычислите ∆ G 0 этой реакции при разных температурах и определите, куда смещается равновесие с ростом температуры.
Ответ: –2,8 кДж/моль; +2,5 кДж/моль. Равновесие смещается в сторону обратной реакции 105–107 Реакция протекает по уравнению 2 A Á 2 B + C. Найти начальную концентрацию вещества А при заданной константе равновесия и равновесной концентрации вещества С, моль/л. В начале реакции вещества В и С отсутствовали.
108–110 Обратимая реакция протекает по уравнению 2 A + 3 B Á 6 C + D. Вычислите равновесную концентрацию вещества С, [ C ], и начальные концентрации веществ А и В, CA и CB, по равновесным концентрациям веществ, указанным в таблице. В начале реакции вещества С и D отсутствовали.
Ответы: 108) [ C ] = 8,4; CA = 3,0; CB = 4,6. Все в моль/л. 109) [ C ] = 3,0; CA = 2,1; СB = 2,3. Все в моль/л. 110) [ C ] = 4,8; CA = 3,2; CB = 3,6. Все в моль/л.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 470; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.01 с.) |

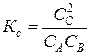 .
.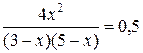 ;
; ;
;  = 1 моль/л.
= 1 моль/л. = 2,5;
= 2,5;  = 1,8;
= 1,8;  =3,6. Рассчитайте константу равновесия реакции и исходные концентрации азота и водорода. Начальная концентрация аммиака равна нулю.
=3,6. Рассчитайте константу равновесия реакции и исходные концентрации азота и водорода. Начальная концентрация аммиака равна нулю.
 = 7,
= 7, 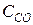 = 10,
= 10,  = 14. Равновесие системы было нарушено из-за уменьшения концентрации H2O до 11 моль/л. Вычислить новые равновесные концентрации реагирующих веществ (С’) после смещения равновесия.
= 14. Равновесие системы было нарушено из-за уменьшения концентрации H2O до 11 моль/л. Вычислить новые равновесные концентрации реагирующих веществ (С’) после смещения равновесия.
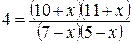 .
.
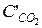 = 7 – 0,44 = 6,56 моль/л;
= 7 – 0,44 = 6,56 моль/л;  = 5 – 0,44 = 4,56 моль/л;
= 5 – 0,44 = 4,56 моль/л;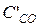 = 10 + 0,44 = 10,44 моль/л;
= 10 + 0,44 = 10,44 моль/л;  = 11 + 0,44 = 11,44 моль/л.
= 11 + 0,44 = 11,44 моль/л.
 числовые значения, получаем:
числовые значения, получаем:
 = 0,09. Начальная концентрация СОСl2 равна нулю. Равновесная концентрация CO равна 0,2 моль/л. Вычислите константу равновесия.
= 0,09. Начальная концентрация СОСl2 равна нулю. Равновесная концентрация CO равна 0,2 моль/л. Вычислите константу равновесия.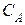 = 0,8 моль/л,
= 0,8 моль/л, 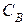 = 0,8 моль/л, а равновесная концентрация вещества С = 0,6 моль/л. Вычислите константу равновесия.
= 0,8 моль/л, а равновесная концентрация вещества С = 0,6 моль/л. Вычислите константу равновесия. , если равновесные парциальные давления
, если равновесные парциальные давления  = 65,7.103, а
= 65,7.103, а  = 65,7.103 Па.
= 65,7.103 Па. = 2;
= 2; 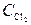 = 3 (моль/л). Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % NO.
= 3 (моль/л). Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % NO. = 0,25;
= 0,25;  = 0,05;
= 0,05;  = 0,9. Вычислите начальные концентрации водорода и иода, если в начале реакции концентрация йодоводорода была равна нулю.
= 0,9. Вычислите начальные концентрации водорода и иода, если в начале реакции концентрация йодоводорода была равна нулю. = 0,7;
= 0,7;  = 0,5. Все в моль/л.
= 0,5. Все в моль/л.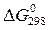 веществ участников реакции (нумерация веществ идет по реакции слева направо).
веществ участников реакции (нумерация веществ идет по реакции слева направо). , кДж/моль
, кДж/моль



