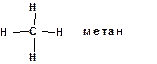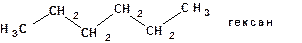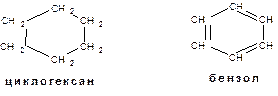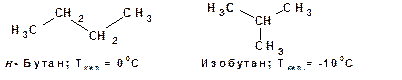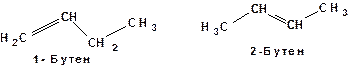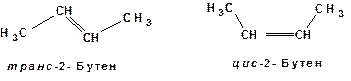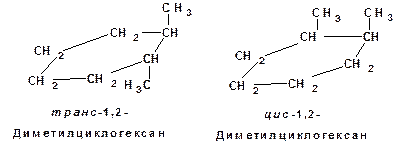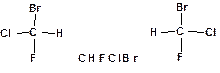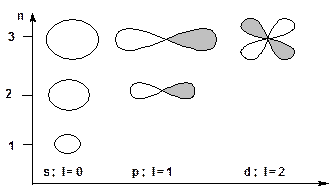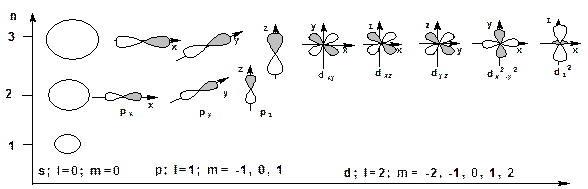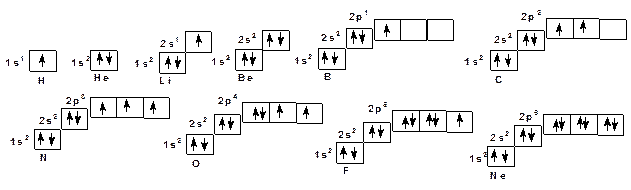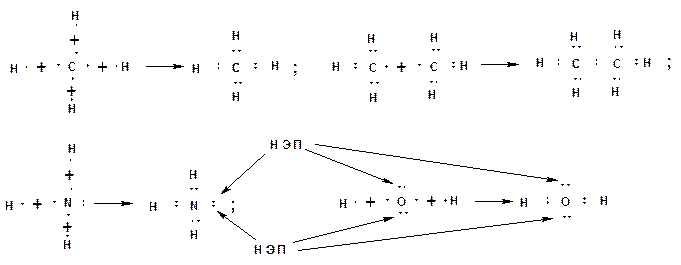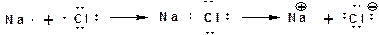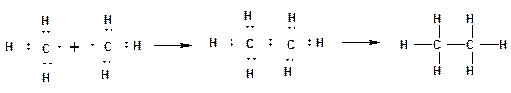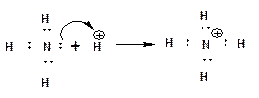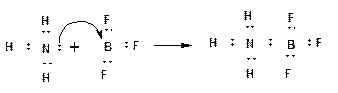Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теория химического строения.Содержание книги Поиск на нашем сайте
В 1858г шотландский химик А. Купер предложил обозначать черточками связи между атомами в молекулах органических соединений. В 1861г русский химик А.М. Бутлеров сформулировал понятие «химическое строение». Развитие представлений о химическом строении привело к созданию А.М. Бутлеровым теории химического строения. Основные положения этой теории сводятся к следующему: 1. Химическая природа каждой молекулы определяется природой составляющих ее атомов, их количеством и химическим строением. 2. Химическое строение – это определенный порядок в чередовании атомов в молекуле и взаимное влияние атомов друг на друга. 3. Химическое строение веществ определяет их физические и химические свойства. 4. Изучение свойств веществ позволяет определить их химическое строение.
Первым практическим следствием теории химического строения явились структурные формулы, с помощью которых можно отразить строение молекулы сочетанием символов атомов и черточек, обозначающих химические связи. При этом всегда следует придерживаться следующих правил: 1. Атомы углерода в молекулах органических соединений всегда четырехвалентны:
2. Атомы углерода в молекулах органических соединений способны образовывать цепи:
3. Атомы углерода в молекулах органических соединений могут быть соединены двумя и тремя связями:
4. Атомы углерода в молекулах органических соединений могут образовывать циклы:
5. Атом или группа атомов, определенным образом соединенные друг с другом и придающие молекулам органических соединений характерные свойства называются функциональными группами.
Изомерия
Понятие «изомеры» введено Берцелиусом в 1830г. Он определил «изомеры» как вещества, имеющие одинаковый состав (молекулярную формулу), но различные свойства. Представление об изомерах Берцелиус ввел после того как установил, что циановая кислота НОСN идентична по составу гремучей или изоциановой кислоте О=С=NН. Теории химического строения объясняет, почему могут существовать органические соединения, имеющие одинаковый состав и различающиеся свойства. Например, эмпирической формуле С4Н10 могут соответствовать два вещества, различающиеся по своему химическому строению и соответственно различающиеся по своим физическим и химическим свойствам:
Такие вещества, имеющие одинаковые эмпирические формулы, но различающиеся по структурным формулам, названы А.М. Бутлеровым структурными изомерами. Существуют следующие виды изомерии: 1. Изомерия углеродного скелета. В этом случае изомеры различаются последовательностью связывания атомов углерода. Например, рассмотренные выше н -бутан и изобутан. 2. Изомерия положения, обусловленная положением функциональных групп или кратных связей. Например:
3. Изомеры с различающейся природой функциональных групп. Например:
4. Геометрические или цис-транс-изомеры. Например:
5. Пространственные изомеры или стереоизомеры. Это органические соединения, имеющие одинаковый состав, т.е. молекулярную формулу и одинаковую последовательность связывания атомов (структурную формулу), но различающиеся расположением атомов в пространстве. Подобное строение имеют молекулы, обладающие атомом углерода с четырьмя различными заместителями. Такие атомы называются асимметрическими или хиральными. Например:
Такие изомеры различаются как предмет и его зеркальное отражение. Эти изомеры обладают одинаковыми физическими и химическими свойствами кроме одного. Они различным образом взаимодействуют с поляризованным светом. Один изомер вращает плоскость поляризации вправо, а другой влево. Поворотные изомеры Теория химического строения заложила основы для факта существования изомеров, но не смогла объяснить, причину различий в химических свойствах изомеров. Вплотную подойти к установлению взаимосвязи между строением молекулы органического вещества и его химическими свойствами удалось в начале ХХ века, когда Льюис положил, что черточкой в структурной формуле обозначается пара электронов. Электронное строение атома.
Современные представления о природе химической связи сложились после создания квантовой механики. Согласно квантово-механическим представлениям электроны в атомах находятся на атомных орбиталях. Под атомной орбиталью подразумевается область пространства вокруг атомного ядра, где наиболее высокая вероятность нахождения электрона. Каждая АО является решением волнового уравнения Шреденгера. Волновое уравнение является дифференциальным уравнением второго порядка. Решениями дифференциальных уравнений являются функции. Решениями дифференциальных уравнений второго порядка являются функции экспоненты «еr» и круговых функций «sinφ» и «cosΘ». В условиях квантования экспонента и круговые функции зависят также от трех чисел, которые принимают определенные значения. В этим числам относятся: 1. Главное квантовое число «n», которое определяет энергию и размер АО и принимает положительные целочисленные значения. Эти значения соответствуют номеру периода в таблице Менделеева.
2. Орбитальное квантовое число (побочное или азимутальное) «l» характеризует форму орбитали и принимает значения от 0 до n-1 (l = 0, 1, 2, …. n-1). АО для l=0 имеет форму сферы и называется s – орбиталью. АО для l = 1 имеет форму гантели и называется p–орбиталью. АО для l = 2 имеет форму лепестков и называется d-орбиталью:
3. Магнитное квантовое число «m». Характеризует пространственную ориентацию и принимает значения 0, ±1, ±2, ….±l
Различные значения «m» для р-орбиталей означают различную пространственную ориентацию. Так р-орбитали ориентированы по трем координатным осям и называются соответственно рх, рy и рz. Ориентация по координатным осям обуславливает их взаимную перпендикулярность или ортогональность. У каждой р-орбитали есть узловая точка, в которой волновая функция обращается в нуль и меняет знак на противоположный. Смена знака волновой функции связана с ростом энергии АО. Чем больше случаев смены знака АО тем выше она по энергии. Из этого следует что из трех видов АО: s, p и d наиболее низкой является s у нее отсутствует узловая точка. Далее следуют p-орбиталь с одной узловой точкой. Еще выше расположены d –орбитали, у которых две узловые точки. Кроме перечисленных квантовых чисел действует еще одно – так называемый спин, характеризующий квантование движения самого электрона. Спин принимает два значения ½ и – ½. По мере роста порядкового номера элемента в таблице Менделеева происходит заселение АО. Заселение проводится в соответствии со следующим правилами: 1. Соблюдается принцип минимума энергии в соответствие с ростом главного квантового числа. 2. Соблюдается правило Клечковского в соответствии с ростом суммы главного и орбитального квантового числа. 3. По принципу Паули в атоме не может быть двух электронов с одинаковым набором квантовых чисел. 4. По правилу Гунда заселение идет таким образом, чтобы суммарный спин был максимален. Графически АО часто изображают в виде квадратика – ячейки. В соответствии с перечисленными правилами ячейки будут заполняться следующим образом:
Как видно из ячеечных формул различаются два вида АО. Одни заполнены, другие заполняются. Главное квантовое число заполняемых АО, как правило, соответствует номеру периода в таблице Менделеева. Оно соответствует внешним электронным оболочкам. Электроны, находящиеся на внешних, заполняемых электронных оболочках участвуют в образовании химической связи.
Химическая связь. Химическая связь образуется за счет перекрывания АО, взаимодействующих атомов и обобществления этими атомами пары электронов с антипараллельными спинами. По правилу октетов, сформулированному Льюисом, каждый атом стремится заполнить свою оболочку до устойчивого состояния, соответствующего инертному газу. Для атома водорода это два электрона, что соответствует электронной оболочке атома гелия. Для элементов второго периода восемь электронов, что соответствует электронной оболочке атома неона. На рисунке приведены схемы образования устойчивых оболочек атомов водорода, углерода, азота и кислорода на примерах образования метана из углерода и водорода, этана из двух метильных радикалов, аммиака из азота и водорода, воды из кислорода и водорода. Стрелками указаны неподеленные электронные пара атомов азота и кислорода.
Различают два вида химической связи: электровалентная и ковалентная. Электровалентная связь осуществляется когда пара электронов полностью переходит на орбитали одного из атомов, имеющему большую электроотрицательность:
Виды ковалентной связи: 1. Собственно ковалентная связь образуется между атомами одной природы при условии равной электроотрицательности, например, между атомами углерода в молекуле этана:
2. При взаимодействии электрически нейтральной молекулы, в состав которой входит атом с НЭП, с ионом несущим положительный заряд и, соответственно, обладающим вакантной орбиталью, НЭП может переместиться на вакантную орбиталь, что приводит к образованию ковалентной связи. Образовавшаяся связь называется координационной:
На представленной схеме стрелка указывает направление смещения электронной плотности. В соответствии с особенностями электронно-дырочной проводимости, в ходе перемещения НЭП на вакантную орбиталь - положительный заряд иона водорода перетекает на атом азота. 3. Если электрически нейтральная молекула, в состав которой входит атом с НЭП, взаимодействует с электрически нейтральной молекулой, в состав которой входит атом, обладающий вакантной орбиталью, то НЭП, также как и в случае координационной связи, переходит на вакантную орбиталь. При этом образуется ковалентная связь, которая называется донорно-акцепторной:
Атом, поставляющий электронную пару - называется донором. Атом, принимающий электронную пару на вакантную орбиталь - называется акцептором.
4. Ковалентная семиполярная или полуполярная связь образуется в случае переноса с орбитали атома-донора на орбиталь атома-акцептора только одного электрона (в отличие от координационной и донорно-акцепторной связей, где переносится НЭП). Например:
Свойства ковалентной связи.
Ковалентная связь обладает следующими свойствами: 1. Ковалентная связь насыщенная (в отличие от электровалентной которая ненасыщенная и ненаправленная) поскольку образована парой электронов. 2. Ковалентная связь характеризуется длиной и направленностью, поскольку образующие ее орбитали занимают определенный объем вокруг атомного ядра и имеют определенную пространственную ориентацию. 3. Ковалентная связь, образованная атомами, различающимися по своей природе и электроотрицательностьи, является полярной. Электронная пара, осуществляющая связь смещается в сторону более электроотрицательного атома. Мерой полярности ковалентной связи является дипольный момент. 4. Ковалентная связь обладает поляризуемостью. Это отклонение от стационарного состояния электронной плотности (пары) под действием внешних факторов. Мерой поляризуемости является молекулярная рефракция. 5. Ковалентная связь характеризуется энергией. Под энергией связи подразумевается энергия необходимая для разрыва связи. Поскольку после разрыва связи потенциальная энергия несвязанных атомов равна нулю, то исходная энергия связи является отрицательной величиной. 6. Химическая связь - это понижение энергии системы из взаимодействующих атомов.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 426; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.89.130 (0.009 с.) |