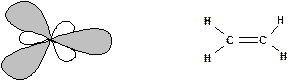Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гибридизация – это смешение орбиталей, на которых располагаются внешние валентные электроны, и выравнивание орбиталей по форме и энергии.Содержание книги
Поиск на нашем сайте
Основное состояние атома углерода 2s22p2. Подобная конфигурация предполагает возможность образование либо двух МО с участием р-электронов, либо трех неравноценных МО. Однако по теории химического строения атом углерода всегда четырехвалентен. Причем экспериментальным путем доказано, что, например, в молекуле метана:
все четыре химические связи между атомом углерода и атомами водорода совершенно одинаковые. Имеют длину 0.111нм или 1.11А0, энергию 422.9кДж/моль и расположены в пространстве по углом 109028' по отношению друг к другу в направлении вершин тетраэдра. Данные эксперимента противоречат электронной конфигурации основного состояния. Для объяснения экспериментальных фактов химики предположили, что, поскольку образование химической связи (образование связующей МО, имеющей отрицательную энергию) приводит к общему понижению потенциальной энергии электронных оболочек атомов, образующих химическую связь, т. е. в целом происходит выигрыш в энергии, то перед взаимодействием атомы затрачивают энергию на два процесса: 1. распаривание s–электронов и переход одного s–электрона на вакантную р-орбиталь
2. смешение s- и р-уровней. Смешение происходит по принципу, примененному для построения МО. В случае МО рассматривается линейная комбинация орбиталей разных (взаимодействующих) атомов. В случае гибридизации валентных электронов линейная комбинация формируется орбиталями основного состояния только одного атома, для которого рассматривается гибридизация. Гибридные орбитали обозначаются символом, который указывает, какие орбитали основного состояния атома участвуют в гибридизации и в каком количестве. Количество орбиталей обозначается надстрочным индексом над буквой обозначающей орбиталь, причем единица не ставится. Например, sр3, sр2, sр. В первом случае в гибридизации участвует одна s-орбиталь и три р-орбитали, во втором одна s-орбиталь и две р-орбитали, в третьем одна s-орбиталь и одна р-орбиталь. По правилу образования линейной комбинации: сколько орбиталей участвовало в комбинации столько должно получиться гибридных орбиталей. В случае sр3 - четыре:
В случае sр2 - три:
В случае sр - две:
Образующиеся гибридные орбитали не должны взаимодействовать друг с другом, т. е. Не должны перекрываться. Это так называемое условие ортогональности, что обеспечивает минимум энергии отталкивания отрицательных зарядов. Этому условию удовлетворяет следующее расположение гибридных орбиталей: 1. sр3 Поскольку в образовании sр3-гибридной орбитали участвуют три атомных р-орбитали ориентированные в пространстве по трем координатным осям, то и гибридные орбтали имеют пространственное расположение в направлении вершин тетраэдра (тетрагональная ориентация), под углом 109028', что соответствует строению молекулы метана:
молекулы, построенные из атомов, в состоянии sр3-гибридизации имеют пространственное строение. 2. sр2 Поскольку в образовании sр2-гибридной орбитали участвуют две атомные р-орбитали ориентированные в плоскости по двум координатным осям, то и гибридные орбитали имеют расположены в плоскости в направлении вершин правильного треугольника (тригональная ориентация), под углом 1200 друг к другу, что соответствует строению молекулы этилена:
Молекулы, построенные из атомов, в состоянии sр2-гибридизации имеют плоскостное строение. 3. sр. Поскольку в образовании sр-гибридной орбитали участвует одна атомная р-орбиталь ориентированная по координатной оси, то и гибридные орбитали расположены на оси, под углом 1800 друг к другу (дигональная ориентация), что соответствует строению молекулы ацетилена:
Молекулы, построенные из атомов, в состоянии sр-гибридизации имеют линейное строение. При перекрывании гибридных орбиталей с другими орбиталями, например с орбиталями атомов водорода в молекуле метана:
происходит вдоль линии, соединяющей ядра атомов. Связь, образовавшаяся в результате перекрывания вдоль оси называется σ-связью. σ-связь имеет осевую симметрию и не имеет узловых точек. σ-связь в молекуле аналогична s-орбитали атомов. Причем если атом связан с другим атомом только одной связью то эта связь обязательно σ-связь.
В случае молекулы построенной из атомов в состоянии sр2-гибридизации три гибридные орбитали образуют три σ-связи. Оставшаяся 2рz-орбиталь расположена перпендикулярно плоскости σ-остова. Но две 2рz-орбитали соседних атомов также могут перекрываться:
В результате такого перекрывания образуется связь обладающая плоскостной симметрией и узловой плоскостью, расположенной в плоскости σ-связи. Такая связь называется π-связью. По энергии π-связь, обладающая узлом выше чем σ-связь, т.е. менее прочная. π-связь в молекуле аналог р-орбитали в атоме. Причем если атом связан с другим атомом более чем одной связью, то одна связь обязательно σ-, а другая обязательно π-связь. Для молекулы построенной из атомов в состоянии sр-гибридизации три гибридные орбитали образуют две σ-связи. Оставшиеся 2ру и 2рz орбитали расположены в перпендикулярно оси σ-остова. 2ру и 2рz-орбитали соседних атомов также могут перекрываться:
В результате перекрывания образуется две π–связи, расположенные в двух взаимно перпендикулярных плоскостях. В этом случае атомы соединены одной σ-связью и двумя π–связями. Различие в гибридизации атомов углерода является причиной различия в электроотрицательности. Чем ниже степень гибридизации, тем выше электроотрицательность:
При построении молекул надо помнить, что количество гибридных орбиталей (nΨ) атома определяется числом σ-связей и числом НЭП: nΨ = число σ-связей + число НЭП. Например, в молекуле нитрометана:
Атом углерода связан тремя σ-связями с атомами углерода и одной σ-связью с атомом азота. Для атома углерода nΨ = 3+1= 4. Четырем гибридным орбиталям соответствует состояние sр3-гибридизации. Атом углерода в молекуле нитрометана находится в состоянии sр3-гибридизации. Атом азота связан одной σ-связью с атомом углерода, двумя σ-связями с атомами кислорода. Для атома азота nΨ = 1+2= 3. Трем гибридным орбиталям соответствует состояние sр2-гибридизации. Атом азота в молекуле нитрометана находится в состоянии sр2-гибридизации. Атом кислорода, связный двойной связью с атомом азота, имеет одну σ-связь и две НЭП. Для атома кислорода nΨ = 1+2= 3. Трем гибридным орбиталям соответствует состояние sр2-гибридизации. Атом кислорода, связный двойной связью с атомом азота, находится в состоянии sр2-гибридизации. Атом кислорода, связный семиполярной связью с атомом азота, имеет одну σ-связь и три НЭП (третья НЭП за счет электрона, перешедшего с орбиталей атома азота) Для атома кислорода nΨ = 1+3= 4. Четырем гибридным орбиталям соответствует состояние sр3-гибридизации. Атом кислорода, связный семиполярной связью с атомом азота, находится в состоянии sр3-гибридизации.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 324; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.86.53 (0.006 с.) |