Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 3.4. Химические системыСодержание книги
Похожие статьи вашей тематики
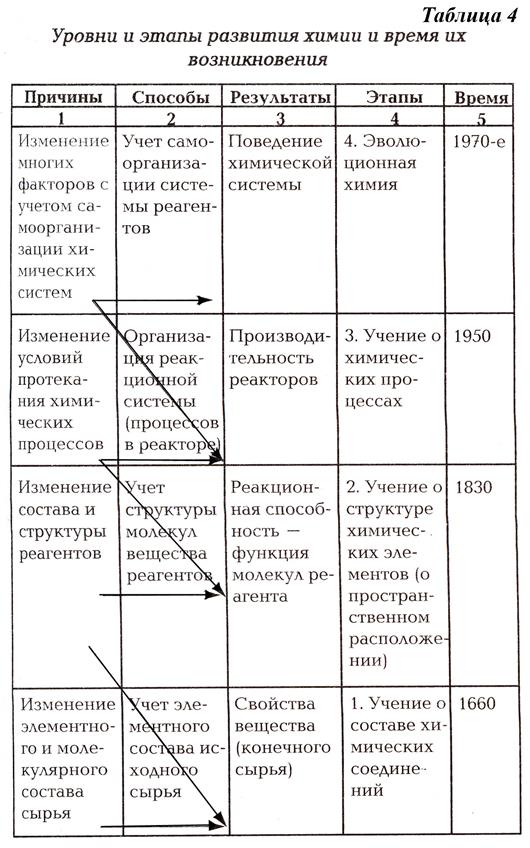
Поиск на нашем сайте O Основные понятия Атом. Изотопы. Невозможность классического описания поведения электронов в атоме. Дискретность электронных состояний в атоме. Организация электронных состояний атома в электронные оболочки. Переходы электронов между электронными состояниями как основные атомные процессы (возбуждение и ионизация). Химический элемент. Молекула. Вещества: простые и сложные (соединения). Понятие о качественном и количественном составе вещества. Катализаторы. Биокатализаторы (ферменты). Полимеры. Мономеры. & Краткое содержание Химия – это экспериментальная наука о превращениях веществ. Д.И. Менделеев: ü «Химия – это учение об элементах и их соединениях». ü «Химия сама создает свой предмет исследования, т.к. одновременно является и наукой, и производством» Главная задача химии – получение веществ с заданными свойствами и установление способов управления свойствами веществ в процессе их превращения. Эволюция химических знаний: 1. химическое ремесло (эпоха древних цивилизаций – Египет, Китай, Индия) 2. алхимия 3. техническая химия – металлургия, стеклоделие, производство керамики, бумаги, спиртных напитков – влияние развития промышленности на эволюцию химических знаний о строении веществ и химических процессах Теоретическая химия (химия как наука): 4. учение о составе (химия как наука о качественных изменениях тел, происходящий в результате изменения их состава (состав → свойства → функции): учение Р. Бойля о составе вещества, идеи атомизма в химии; теория флогистона – вещества, удаляющегося из материалов при их горении; закон сохранения массы вещества – М.В. Ломоносов, А.Лавуазье; атомно-молекулярное учение: закон постоянства состава – Пруст; закон кратных отношений, понятие «молекула», «атомный вес»– Дж.Дальтон; периодическая система элементов – Д.И. Менделеев – химия как количественная наука. 5. развитие структурной химии – определение свойств химических веществ в зависимости не только от состава, но и от структуры: химическая атомистика Дж. Дальтона; теория И. Берцелиуса; развитие представлений о структуре молекул М. Жераром и Ф. Кекуле; теория химического строения A.M. Бутлерова и развитие органической химии 6. учение о закономерностях химических процессов – проблемы управления химическим процессом; химическая кинетика; принцип Ле Шателье; катализ. 7. эволюционная химия – наука о самоорганизации и саморазвитии химических систем Центральное понятие всей химии – это вещество и процессы его превращения, или химическая реакция. Фундаментальная модель химии – молекула. Классические модели химических процессов – уравнения реакций. Вещество – это форма материи, обладающая массой покоя. Состоит из элементарных частиц: электронов, протонов, нейтронов и т. д. Химия изучает большей частью вещества, организованные в атомы, молекулы, ионы и радикалы. Вещества принято разделять на простые (состоящие из одного химического элемента) и сложные (образованы несколькими химическими элементами). · фактически большинство веществ в природе или химическом производстве – вещества переменного состава (бертоллиды) · вещества постоянного состава (дальтониды) – исключение; можно считать классической моделью реального вещества Вещество в земных условиях встречается в четырех агрегатных состояниях: газообразное, жидкое, твердое, плазма. Высказываются предположения, что вещество может существовать в других особых сверхплотных состояниях (например, в нейтронных звездах) Вещество, с которым мы сталкиваемся в повседневной жизни, состоит из атомов. В состав атомов входит атомное ядро, состоящее из протонов и нейтронов, а также электроны, «вращающиеся» вокруг ядра (квантовая механика использует понятие «электронное облако»). Протоны и нейтроны относятся к адронам (которые состоят из кварков). Следует отметить, что в лабораторных условиях удалось получить «атомы», состоящие и из других элементарных частиц. Атомы каждого химического элемента имеют в своём составе одно и то же количество протонов, называемое атомным номером или зарядом ядра. Однако количество нейтронов может различаться, поэтому один химический элемент может быть представлен несколькими изотопами. В настоящее время известно свыше 110 элементов, наиболее массивные из которых нестабильны. Атомы могут взаимодействовать друг с другом, образуя химические вещества. Взаимодействие происходит на уровне их электронных оболочек. Химические вещества чрезвычайно многообразны. Наука пока не решила задачу точного предсказания физических свойств химических веществ. Элементарная частица – это все частицы, не являющиеся атомными ядрами или атомами (исключение — протон). В узком смысле — частицы, которые нельзя считать состоящими из других частиц (при заданной энергии воздействия/наблюдения). Атом – наименьшая частица химического элемента, обладающая всеми его свойствами. Атом состоит из ядра и "облака" электронов вокруг него. Ядро состоит из положительно заряженных протонов и нейтральных нейтронов. Взаимодействуя, атомы могут образовывать молекулы. Молекула – частица, состоящая из двух или более атомов, которая может самостоятельно существовать. Имеет постоянный качественный и количественный состав. Её свойства зависят от атомов, входящих в её состав, и от характера связей между ними, и от их пространственного расположения (изомеры). Может иметь несколько разных состояний и переходить от одного состояния к другому под действием внешних факторов. Свойства вещества, состоящего из определённых молекул, зависят от состояния молекул и от свойств молекулы. Химический элемент – совокупность атомов с одинаковым зарядом ядра. Основными характеристиками химического элемента является атомный номер и атомная масса. Взаимосвязь химических элементов отражена в периодической системе элементов Менделеева. Химическое соединение – сложное вещество, состоящее из химически связанных атомов двух или нескольких различных элементов. Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (например, азот N2, кислород O2 и др.). Состав химических соединений записывается в виде химических формул, а строение часто изображается структурными формулами. В подавляющем большинстве случаев химические соединения подчиняются закону постоянства состава и закону кратных отношений. Однако известны довольно многочисленные соединения переменного состава. Химические соединения получают в результате химических реакций. Образование их сопровождается выделением или поглощением энергии. Физические и химические свойства соединений отличаются от свойств веществ, из которых они получены. Характеризуются определёнными значениями плотности, температуры плавления и кипения и др. константами. Соединения, имеющие один и тот же состав, но различное строение, отличаются по свойствам. Химические соединения разделяются на неорганические и органические. Известно более 100 тыс. неорганических и более 3 млн. органических соединений. Ион – это заряженная частица, атом или молекула, которая имеет неодинаковое количество протонов и электронов. Если у частицы больше электронов, чем протонов, то она заряжена отрицательно и называется анион. Например — Cl-. Если в частице электронов меньше, чем протонов, значит, она заряжена положительно и называется катион. Например — Na+. Радикал – это частица (атом или молекула), содержащая нечётное число электронов. В большинстве случаев химическая связь образуется при участии двух электронов. Частица, имеющая неспаренный электрон, очень активна и легко образует связи с другими частицами. Поэтому время жизни радикала в среде, как правило, очень мало. Химическая связь – удерживает атомы или группы атомов друг около друга. Различают несколько видов химической связи: ионную, ковалентную (полярную и неполярную), металлическую, водородную и другие. Химическая реакция – это процесс изменения структуры молекулы. В результате реакции количество атомов в молекуле может увеличиваться (синтез), уменьшаться (разложение) или оставаться постоянным (изомеризация, перегруппировка). В ходе реакции изменяются связи между атомами и порядок размещения атомов в молекулах. Валентность – способность вещества связываться с одним или большим числом веществ Закон сохранения массы вещества: исторически сложившееся в химии название закона, по которому общая масса (вес) веществ, вступающих в реакцию, равна общей массе (весу) продуктов реакции. Открыт М. В. Ломоносовым в 1748 и им же экспериментально подтвержден в 1756 на примере обжигания металлов в запаянных сосудах. Широкое распространение в химии закон получил благодаря трудам А. Лавуазье, который сформулировал его в 1789. Закон. лежит в основе количественных расчётов химических реакций. Строго говоря, с точки зрения современных представлений о связи между массой и энергией, закон не точен. Периодический закон Открыт Д. И. Менделеевым. Современная формулировка: Свойства элементов, а также образуемых ими соединений находятся в периодической зависимости от зарядов ядер их атомов.
Современное учение о химических процессах — наглядный пример глубокой взаимосвязи физических, химических и биологических знаний. В основе данного учения лежат химическая термодинамика и кинетика — традиционные области физической химии. Способность к взаимодействию различных реагентов определяется не только их атомарно-молекулярной структурой, но и условиями протекания химических реакций. К условиям протекания химических процессов относятся термодинамические (характеризуют зависимость реакций от температуры, давления и т.п.) и кинетические факторы. Термодинамическое воздействие влияет преимущественно на направление химических процессов. Функции управления скоростью химических процессов выполняет химическая кинетика. Она устанавливает зависимость протекания химических процессов от множества структурно-кинетических факторов: строения исходных реагентов; их концентрации; наличия в реакторе катализаторов (или ингибиторов) и других добавок; способа смешивания реагентов; материала и конструкции реактора и т.п. Влияние такого типа факторов на ход химических реакций может быть сведено и к катализу, т.е. к положительному воздействию на химический процесс, и к ингибированию, сдерживающему процесс. Катализ — это процесс изменения скорости или возбуждения химической реакции веществами-катализаторами, которые участвуют в реакции, но не входят в состав конечных продуктов. Вещества, замедляющие химическую реакцию, называются ингибиторами. Катализ играет решающую роль в процессе перехода от химических систем к биологическим.
Химические процессы подчиняются всеобщим законам природы: закону сохранения массы вещества, закону сохранения энергии, а также ряду специфических для химии законов, которыми управляются все химические реакции. По механизму химические процессы делятся на 3 основных типа: · простые реакции между молекулами; · радикальные, в том числе цепные реакции (протекающие через промежуточное образование свободных радикалов и атомов); · ионные (идущие при участии ионов). Химические реакции – превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в химических реакциях неизмененными; этим химические реакции отличаются от ядерных реакций. Химические реакции осуществляются при взаимодействии веществ между собой или при внешних воздействиях на них температуры, давления, электрического и магнитного полей и т.п. В ходе химических реакций одни вещества (реагенты) превращаются в другие (продукты реакции), что записывается в виде химических уравнений. Реагенты и продукты реакции часто носят общее название реактанты. Каждая химическая реакция характеризуется стехиометрическим соотношением реактантов и скоростью химической реакции. Совокупность отдельных стадий химических реакций, установленная экспериментально или предложенная на основе теоретических представлений, называется механизмом реакции. Любая химическая реакция обратима, хотя скорости прямой и обратной реакций могут при этом существенно отличаться. Когда скорости прямой и обратной реакций равны, система находится в химическом равновесии. В положении равновесия или вблизи него поведение системы описывается законами и соотношениями химической термодинамики. При изучении химических реакций на молекулярном уровне используют представления о взаимодействии атомов и молекул при их столкновениях друг с другом, с электронами и др. частицами, о превращениях молекул при поглощении и испускании фотонов и т.п. Этот подход базируется, как правило, на квантовой теории и связан в основном с изучением элементарного акта химических реакций, т. е. отдельного процесса столкновения молекул реактантов. Химические реакции существенно зависят как от природы реактантов, так и от внешних условий реакции. Многие химические реакции возможны только под воздействием внешних источников энергии: тепловой, электромагнитной (фотохимические реакции), электрической (электрохимические реакции). При этом сама химическая реакция может служить источником энергии. Количественное экспериментальное изучение химических реакций привело к установлению ряда основных законов химии, отражающих как стехиометрию, так и энергетику реакций. К таким законам относятся закон постоянства состава, закон Гесса и др. Классификация химических реакций проводится по различным признакам и различается в зависимости от того, в какой области химии они исследуются. Термодинамическая классификация · по энергетике реакций: - экзотермические, т. е. идущие с выделением тепла, - эндотермические, т. е. идущие с поглощением тепла; · по количеству фаз реактантов - гомогенные реакции - гетерогенные реакции Кинетическая классификация · по скорости прямой и обратной реакций - обратимые - необратимые · по числу взаимосвязанных реакций в системе - простая реакция, т. е. только одна, практически необратимая реакция - сложная реакция, которую можно подразделить на несколько простых. Сложные химические реакции по форме связи простых реакций подразделяются на параллельные, последовательные, сопряжённые, обратимые и т.д. В отдельную группу выделяется обширный класс каталитических реакций. В неорганической химии широко используется классификация химических реакций по типам участвующих в них соединений и по характеру их взаимодействия: - реакции образования и разложения, - реакции гидролиза, - реакции нейтрализации - реакции окисления-восстановления. Органические реакции подразделяют на две большие группы: - гетеролитические, при которых разрыв связи в молекуле происходит несимметрично и электроны остаются спаренными, - гомолитичные, в которых происходит симметричный разрыв связи, в результате чего образуются радикалы. Понятие химических реакций является в известной степени условным. Учение о химических процессах – кинетика химических реакций –- учение о законах протекания процессов во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической промышленности: разработка рациональных принципов управления химическими процессами; стимулирование полезных и торможение и подавление нежелательных химических реакций; создание новых и усовершенствование существующих процессов и аппаратов в химической технологии; изучение поведения химических продуктов, материалов и изделий из них в различных условиях применения и эксплуатации. В реальных условиях, например в крупных промышленных аппаратах, химический процесс осложняется в связи с передачей тепла, выделяемого или поглощаемого в реакции, транспортом веществ в зону реакции, их искусственным или естественным перемешиванием. Эти проблемы решает так называемая макрокинетика. Вместе с тем многие уравнения, описывающие протекание во времени химических реакций, пригодны и для описания ряда физических процессов (распад радиоактивных ядер, деление ядерного горючего), а также для количественной характеристики развития некоторых биохимических, в том числе ферментативных, и других биологических процессов (нормальный и злокачественный рост тканей, развитие лучевого поражения, кинетические критерии оценки эффективности лечения). Кинетика химических реакций лежит в основе исследования сложных процессов горения газов и взрывчатых веществ, помогает изучению процессов в двигателе внутреннего сгорания. Таким образом, можно говорить об общей кинетике, частным случаем которой является кинетика химических реакций. Эти аналогии весьма удобны для практического использования, но всегда следует иметь в виду принципиальные различия в природе рассматриваемых явлений. В основе кинетики химических как учения о скоростях химических превращений лежит закон действующих масс, согласно которому скорость реакции веществ А, В, С,... пропорциональна произведению их концентр аций. Скорость реакции характеризуется обычно изменением за единицу времени концентрации какого-либо из исходных веществ или конечных продуктов реакции. ü Закон действующих масс – один из основных законов физической химии; устанавливает зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия. Норвежские учёные К. Гульдберг и П. Вааге, сформулировавшие закон в 1864-67, назвали «действующей массой» вещества его количество в единице объёма, т. е. концентрацию, отсюда - наименование закона. ü Закон Гесса: тепловой эффект любой химической реакции зависит лишь от начального и конечного состояния системы и не зависит от промежуточных состояний и путей перехода. Сейчас этот закон мы можем рассматривать, как применение закона сохранения и превращения энергии к термохимическим реакциям. Энергия химической связ и – важная характеристика, определяющая реакционную способность вещества и использующаяся при термодинамических и кинетических расчетах химических реакций. Энергия химической связиравна работе, которую необходимо затратить, чтобы разделить молекулу на две части (атомы, группы атомов) и удалить их друг от друга на бесконечное расстояние. Например, если рассматривается энергия химической связи H3C-H в молекуле метана, то такими частицами являются метильная группа CH3 и атом водорода Н, если рассматривается энергия химической связи Н-Н в молекуле водорода, такими частицами являются атомы водорода. Энергия химической связи - частный случай энергии связи, обычно ее выражают в кдж/моль (ккал/моль); в зависимости от частиц, образующих химическую связь, характера взаимодействия между ними (ковалентная связь, водородная связь и другие виды химической связи), кратности связи (например, двойные, тройные связи) энергия химической связи имеет величину от 8-10 до 1000 кдж/моль. Для молекулы, содержащей две (или более) одинаковых связей, различают энергия химической связи каждой связи (энергию разрыва связи) и среднюю энергию связи, равную усредненной величине энергии разрыва этих связей. Так, энергия разрыва связи HO-H в молекуле воды, т. е. тепловой эффект реакции H2O = HO + H равен 495 кдж/моль, энергия разрыва связи Н-О в гидроксильной группе - 435 кдж/моль, средняя же энергия химической связи равна 465 кдж/моль. Различие между величинами энергий разрыва и средней энергия химической связи обусловлено тем, что при частичной диссоциации молекулы (разрыве одной связи) изменяется электронная конфигурация и взаимное расположение оставшихся в молекуле атомов, в результате чего изменяется их энергия взаимодействия. Величина энергия химической связи зависит от начальной энергии молекулы, об этом факте иногда говорят как о зависимости энергия химической связи от температуры. Обычно энергия химической связи рассматривают для случаев, когда молекулы находятся в стандартном состоянии или при 0 К. Именно эти значения энергия химической связи приводятся обычно в справочниках. Энергия химической связи может быть косвенно определена по данным калориметрических измерений, расчетным способом, а также с помощью масс-спектроскопии и спектрального анализа. Реакционная способность -характеристика химической активности веществ, учитывающая как разнообразие реакций, возможных для данного вещества, так и их скорость. Например, ü благородные металлы (Au, Pt) и инертные газы (Не, Ar, Kr, Xe) химически инертны, т. е. у них низкая реакционная способность; ü щелочные металлы (Li, Na, К, Cs) и галогены (F, Cl, Вг, I) химически активны, т. е. обладают высокой реакционная способность. ü насыщенные углеводороды (органическая химия) характеризуются низкой реакционной способностью, для них возможны немногочисленные реакции, происходящие в жёстких условиях (высокая температура, ультрафиолетовое облучение). Количественно реакционная способность выражают константами скоростей реакций или константами равновесия в случае обратимых проц ессов. Современные представления о реакционной способности основаны на электронной теории валентности и на рассмотрении распределения (и смещения под действием реагента) электронной плотности в молекуле. Электронные смещения качественно описываются в терминах индуктивных и мезомерных эффектов, количественно — с применением квантовомеханических расчётов. Главный фактор, определяющий относительную реакционную способность в ряду родственных соединений, — строение молекулы: характер заместителей, их электронное и пространственное влияние на реакционный центр, геометрия молекул. Реакционная способность зависит и от условий реакции (природы среды, присутствия катализаторов или ингибиторов, давления, температуры, облучения и т.п.). Все эти факторы оказывают на скорость реакций различное, а иногда противоположное влияние в зависимости от механизма данной реакции. Количественная связь между константами скорости (или равновесия) в пределах одной реакционной серии может быть представлена корреляционными уравнениями, описывающими изменения констант в зависимости от изменения какого-либо параметра. Катализ (от греч. katálysis - разрушение) – изменение скорости химических реакций в присутствии веществ (катализаторов), вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав. Реакции с участием катализаторов называются каталитическими. Количество реагирующего вещества, которое может испытать превращение в присутствии определённого количества катализатора, не ограничивается какими-либо стехиометрическими соотношениями и может быть очень большим. Этим каталитические реакции отличаются от индуцируемых, или сопряжённых реакций, когда одна реакция вызывается или ускоряется (индуцируется) другой и происходит необратимое превращение вещества-индуктора. Возможные изменения катализатора при каталитических реакциях являются результатом побочных процессов, ни в коей мере не обусловливающих каталитическое действие. Катализатор - вещество, ускоряющее скорость химической реакции. Катализаторы изменяют скорость химических реакций посредством многократного промежуточного химического взаимодействия с участниками реакций и не входящие в состав конечных продуктов. Катализаторы повсеместно распространены в живой природе и широко используются в промышленности. Более 70% всех химических превращений веществ, а среди новых производств более 90% осуществляется с помощью катализаторов. Различные катализаторы, выпускаемые промышленностью, классифицируются по типу катализируемых реакций (кислотно-основные, окислительно-восстановительные); по группам каталитических процессов или особенностям их аппаратурно-технологического оформления (например, К. синтеза аммиака, крекинга нефтепродуктов, К. для использования в псевдоожиженном слое); по природе активного вещества (металлические, окисные, сульфидные, металлоорганические, комплексные и т.д.); по методам приготовления. При помощи белковых катализаторов - ферментов - осуществляется обмен веществ у всех живых организмов. Фермент – биологический катализатор; по химической природе - белок или рибонуклеиновая кислота. Ферменты обязательно присутствуют во всех клетках живого организма. Ускоряя биохимические реакции, ферменты направляют и регулируют обмен веществ. Ингибитор (лат. Inhibeo – удерживаю)- в химии - вещество, снижающее скорость химических реакций или подавляющие их. Ингибиторы применяют для предотвращения или замедления нежелательных процессов: коррозии металлов, старения полимеров, окисления топлива и смазочных масел, пищевых жиров и др. Ингибитор - в биологии - любой агент, тормозящий тот или иной биологический процесс
|
||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 1741; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.01 с.) |