
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химических реакций и химическое равновесиеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: исследовать влияния различных факторов на скорость гомогенных и гетерогенных реакций и химическое равновесие. Реактивы: раствор йодата калия ( Посуда: стеклянные стаканы емкостью 50 см3, пробирки, капельные пипетки, цилиндры. Оборудование: секундомеры, термостат, держатели для пробирок, штативы.
Краткие теоретические сведения
Скорость химических реакций Учение о механизме и скорости протекания химических реакций называется химической кинетикой. При рассмотрении вопроса о скорости химических реакций необходимо различать реакции, протекающие в гомогенной или гетерогенной системах. Системой в химии называют рассматриваемое вещество или совокупность веществ. Система отделена от внешней среды. Гомогенной называют систему, состоящую из одной фазы. Она может быть в газообразном (воздух), жидком (морская вода) или твердом состояниях. Гетерогенной называют систему, состоящую из нескольких фаз, например вода со льдом. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства меняются скачкообразно. Реакции, протекающие в гомогенной системе, называются гомогенными, а в гетерогенной системе – гетерогенными. Примером гомогенной реакции может быть любая реакция, протекающая в растворе:
Гомогенные реакции протекают во всем объеме системы. Гетерогенные реакции идут только на поверхности раздела фаз, образующих эту систему, например:
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. В гомогенной системе реакционным пространством является объем. Отношение количества вещества к единице объема называется концентрацией С. Скоростью гомогенной химической реакции называют изменение концентрации вещества в единицу времени. Если в момент времени
Если Если Истинная скорость реакции
Реакционным пространством в гетерогенной реакции является поверхность раздела фаз, поэтому скоростью гетерогенной реакции называется изменение количества вещества в единицу времени на единице площади поверхности раздела фаз:
или через производную:
где Скорость химической реакции определяется следующими основными факторами: 1) природой реагирующих веществ; 2) концентрацией реагирующих веществ; 3) температурой протекания реакции; 4) наличием катализаторов, механизмом реакции и т.д. Зависимость скорости химической реакции от концентрации выражается законом действующих масс, основным законом химической кинетики: при постоянной температуре скорость гомогенной химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степени их стехиометрических коэффициентов. Для химических реакций в общем виде
где Этот коэффициент зависит от природы реагирующих веществ, температуры и наличия катализаторов. Величина этого коэффициента не зависит от концентрации веществ, участвующих в реакции. Для гетерогенных химических реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе, а также площадь поверхности раздела фаз. Концентрация вещества, находящегося в твердой фазе, обычно постоянна и входит в константу скорости. Например, для реакции горения угля
Зависимость скорости химической реакции от температуры определяется приближенным правилом Вант-Гоффа: при повышении температуры на каждые 10º скорость химической реакции увеличивается в 2-4 раза:
где
Величина При концентрации реагирующих веществ 1 моль/дм3 скорость реакции численно равна константе скорости Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса:
где
Энергия активации – это энергия, необходимая для перевода молекул из неактивного состояния в активное, столкновения которых приводят к химическим взаимодействиям. Энергия активации зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше скорость реакции. Энергия активации необходима для ослабления химических связей в исходных веществах и для преодоления отталкивания между электронами при сближении молекул и атомов взаимодействующих веществ. Другими словами, для образования неустойчивого активированного комплекса, который распадается с образованием продуктов реакции. Химические реакции сопровождаются тепловыми эффектами. Если тепловой эффект реакции ΔН < 0, то реакция идет с выделением энергии в окружающую среду, т.е. экзотермическая. Если реакция идет с поглощением энергии из окружающей среды Катализаторы – это вещества, которые ускоряют химические реакции, но не испытывают химических превращений в их результате, т.е. восстанавливают свой состав. Явление изменения скорости химической реакции под воздействием катализаторов называется катализом. Катализаторы снижают энергию активации за счет изменения механизма химических реакций.
Химическое равновесие Все химические реакции можно классифицировать как обратимые и необратимые. Состояние системы, при котором скорости прямой и обратной реакции равны, называется химическим равновесием. Кинетическое химическое равновесие является динамическим: одновременно протекают прямая и обратная реакции. Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ реакции. Для любой обратимой реакции в состоянии равновесия выполняется соотношение:
где Константа равновесия химической реакции показывает глубину превращения исходных веществ в продукты реакции. Для обратимых реакций по величине константы равновесия можно определить величину выхода продуктов реакции. Химическое равновесие зависит от параметров состояния системы и существует при строго определенных значениях концентрации, температуры и давления. При изменении хотя бы одного из параметров равновесие смещается в левую или правую сторону. Направление смещения химического равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия. Увеличение концентрации исходных веществ приводит к смещению равновесия в сторону образования продуктов реакции. При повышении давления (для газов и паров) равновесие смещается в сторону той реакции, при которой наблюдается уменьшение объема системы (в сторону образования меньшего числа молекул); если реакция протекает без изменения объема, то изменение давления не приводит к смещению химического равновесия. При повышении температуры равновесие смещается в сторону протекания эндотермической реакции (
Экспериментальная часть
Опыт 1. Исследование зависимости скорости реакции от концентрации реагирующих веществ. Зависимость скорости реакции от концентрации реагирующих веществ рассмотрим на примере взаимодействия растворов йодата калия ( При взаимодействии раствора йодата калия, содержащего крахмал, сначала образуется йодноватая
Эта реакция протекает медленно. Когда вся сернистая кислота израсходуется, йодноватая кислота реагирует с йодоводородной кислотой:
а выделяющийся йод в присутствии крахмала окрашивает раствор в синий цвет. Это вторая стадия реакции. Суммарное уравнение реакции имеет вид:
или в ионной форме:
Время протекания реакции с момента сливания растворов до появления синего окрашивания отсчитывайте по секундомеру. Для проведения опыта используйте следующие реактивы: - раствор А – раствор йодата калия ( - раствор Б – раствор сульфита натрия Приготовьте 7 чистых и сухих пробирок, 5 микростаканов и две капельные пипетки. Концентрация раствора А остается постоянной, а из раствора Б приготовьте 5 различных концентраций. Для этого в 5 пронумерованных микростаканов налейте из банки по 10 см3 раствора Б. Затем прилейте в микростаканы необходимое количество дистиллированной воды. В первый стакан воду не приливайте (концентрация раствора Б остается той же), во второй микростакан прилейте
Таблица 1 – Зависимость скорости реакции от концентрации реагирующих веществ
В одну из пробирок внесите с помощью капельной пипетки 20 капель раствора Результат опытов запишите в таблицу 1. Для каждого варианта вычислите относительную скорость реакции По полученным данным постройте график зависимости скорости реакции от концентрации. По оси абсцисс отложите значения концентраций раствора сульфита натрия, а по оси ординат – относительную скорость В результате получается параболическая кривая, показывающая степенную зависимость скорости реакции от концентрации. Эта кривая является наглядным подтверждением основного закона химической кинетики. Опыт 2. Исследование зависимости скорости реакции от температуры. Для изучения влияния температуры на скорость химической реакции используется реакция окисления щавелевой кислоты перманганатом калия в присутствии серной кислоты:
или в ионной форме:
В кислой среде ион Опыт проводите в четырех вариантах при разных температурах, как указано в таблице 2. Раствор А – раствор Налейте по 10 капель растворов А и Б в две конические пробирки. Слейте эти растворы в одну пробирку и отсчитывайте время с момента смешения до обесцвечивания раствора, запишите в таблицу 2.
Таблица 2
Т* – комнатная температура.
Затем выполняйте второй вариант опыта, для этого надо взять в две конические пробирки по 10 капель раствора А и Б. Нагрейте эти растворы в течение 5-7 минут в термостате, в котором установлена температура, на 10º превышающая комнатную, или в водяной бане, температуру которой определите по термометру, вставленному в одно из отверстий в крышке. Достаньте пробирку с раствором Проведите опыты при других значениях температуры. Результаты опытов запишите в таблицу 2. По полученным данным постройте график зависимости скорости реакции от температуры. По оси абсцисс отложите значения температуры в градусах Кельвина, а по оси ординат – скорость реакции. Опыт 3. Исследование влияния величины поверхности реагирующих веществ на скорость в гетерогенной системе. Взвесьте на электронных весах кусочек мрамора массой примерно 0,1 г и мрамор в виде порошка такой же массы. В две конические пробирки налейте по 10 капель разбавленной соляной кислоты. Внесите одновременно обе навески мрамора в пробирки с кислотой: кусочек внесите в одну пробирку, порошок – в другую. В какой пробирке реакция протекает быстрее? Заметьте время, которое потребовалось для полного растворения мрамора. Вычислите для обоих случаев относительную скорость Опыт 4. Исследование влияния концентрации реагирующих веществ на химическое равновесие. К 10 каплям раствора хлорида железа (III) концентрации 0,01 моль/дм3 прибавьте 10 капель раствора роданида калия концентрации 0,02 моль/дм3. В результате получается раствор с характерной красной окраской, обусловленной присутствием роданида железа (III)
Для ослабления окраски раствора в пробирку добавьте 5-7 см3 дистиллированной воды. Полученный раствор красного цвета разлейте поровну в четыре конических пробирки. Первую пробирку оставьте для сравнения. Во вторую добавьте несколько капель насыщенного раствора хлорида железа (III). В третью пробирку добавьте несколько капель насыщенного раствора роданида калия. Перемешайте растворы в пробирках. В четвертую пробирку добавьте сухую соль хлорида калия и энергично перемешайте стеклянной палочкой. Наблюдайте и запишите изменение окраски раствора в каждой пробирке. Пользуясь выражением для константы химического равновесия:
объясните изменение окраски растворов во всех пробирках. Опыт 5. Исследование влияния температуры на химическое равновесие. Реакция взаимодействия крахмала с йодом является обратимой и протекает с образованием йодокрахмала (соединение синего цвета) и выделением теплоты. Схематично эту реакцию можно изобразить следующим образом: Йод + крахмал В две пробирки налейте по 4-5 см3 раствора крахмала и добавьте 5-10 капель раствора йода концентрации 0,005 моль/дм3 (до появления окраски синего цвета). Нагревая и охлаждая одну из пробирок, наблюдайте за изменением окраски. Сделайте вывод о влиянии температуры на смещение химического равновесия.
Содержание отчета
1. Название и цель работы. 2. Используемые реактивы, посуда и оборудование. 3. Записать в отчет краткие теоретические сведения. 4. При оформлении первого опыта приведите уравнения химических реакций. Результаты опытов запишите в таблицу 1, рассчитайте скорость реакции для каждого опыта и заполните таблицу 1. Постройте график зависимости скорости реакции от концентрации сульфита натрия. 5. При оформлении второго опыта приведите уравнение химической реакции. Результаты опытов запишите в таблицу 2 и заполните ее. Постройте график зависимости скорости реакции от температуры, вычислите температурный коэффициент скорости реакции. 6. Для третьего опыта приведите уравнение химической реакции и математическое выражение основного закона химической кинетики. Запишите наблюдения, сделайте вывод о влиянии площади поверхности реагирующих веществ на скорость реакции, протекающей в гетерогенной среде. 7. Запишите наблюдения о влиянии компонентов реакции на смещение равновесия, объясните изменение окраски в каждой из пробирок, используя выражение константы химического равновесия для этой реакции. Сделайте выводы о влиянии температуры на смещение химического равновесия.
Контрольные вопросы
1. Сформулируйте закон действующих масс. Напишите уравнение этого закона для следующих реакций: а) б) 2. Каков физический смысл константы скорости химической реакции? От каких факторов она зависит? 3. Как изменится скорость химической реакции а) если увеличить концентрацию б) если уменьшить объем системы в 2 раза? в) если увеличить давление в 2 раза? 4. Какие реакции называются обратимыми? Каков физический смысл константы равновесия? Как повлияет на смещение равновесия реакции а) повышение температуры? б) уменьшение давления?
ЛАБОРАТОРНАЯ РАБОТА № 2 РАСТВОРЫ
Цель работы: приобрести навыки приготовления растворов заданных количественных составов. Приборы: электронные весы, набор ареометров. Реактивы: бихромат калия ( Посуда: химические стаканы на 100 см3, цилиндры, стеклянные воронки и палочки, мерные колбы на 100 см3, часовые стекла.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 1269; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.126.69 (0.01 с.) |

 ) концентрации 0,01 моль/дм3; раствор сульфита натрия
) концентрации 0,01 моль/дм3; раствор сульфита натрия  концентрации 0,01 моль/дм3; раствор серной кислоты (
концентрации 0,01 моль/дм3; раствор серной кислоты ( ) концентрации 1 моль/дм3; раствор крахмала с массовой долей
) концентрации 1 моль/дм3; раствор крахмала с массовой долей  ; раствор перманганата калия (
; раствор перманганата калия ( ) концентрации 0,1 моль/дм3; раствор щавелевой кислоты (
) концентрации 0,1 моль/дм3; раствор щавелевой кислоты ( ) концентрации 0,57 моль/дм3; мрамор кристаллический (
) концентрации 0,57 моль/дм3; мрамор кристаллический (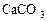 ); соляная кислота (
); соляная кислота ( с массовой долей
с массовой долей  ) концентрации 0,01 моль/дм3; раствор роданида калия (
) концентрации 0,01 моль/дм3; раствор роданида калия ( ) концентрации 0,02 моль/дм3; насыщенный раствор хлорида железа (III) (
) концентрации 0,02 моль/дм3; насыщенный раствор хлорида железа (III) ( ); раствор йода (
); раствор йода ( ) концентрации 0,005 моль/дм3.
) концентрации 0,005 моль/дм3. ,
,  .
. .
. концентрация реагирующего вещества была
концентрация реагирующего вещества была  (моль/дм3), а в последующий момент времени
(моль/дм3), а в последующий момент времени  оказалась равной
оказалась равной  (моль/дм3), то средняя скорость реакции будет выражаться отношением:
(моль/дм3), то средняя скорость реакции будет выражаться отношением: ;
;  – тау.
– тау.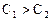 , то
, то  – правая часть уравнения будет отрицательной.
– правая часть уравнения будет отрицательной. , то
, то  – правая часть уравнения будет положительной.
– правая часть уравнения будет положительной. в данный момент времени определяется как первая производная от концентрации по времени:
в данный момент времени определяется как первая производная от концентрации по времени: , моль/дм3·с.
, моль/дм3·с.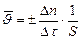 , моль/с·м2,
, моль/с·м2, ,
, – площадь поверхности раздела фаз;
– площадь поверхности раздела фаз;  и
и 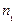 – количество реагирующего вещества в момент времени
– количество реагирующего вещества в момент времени  – изменение количества реагирующего вещества за промежуток времени
– изменение количества реагирующего вещества за промежуток времени  .
. кинетическое уравнение химической реакции будет иметь вид:
кинетическое уравнение химической реакции будет иметь вид: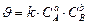 ,
,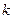 – коэффициент пропорциональности, называемый константой скорости химической реакции, дм3/моль·с.
– коэффициент пропорциональности, называемый константой скорости химической реакции, дм3/моль·с. закон действующих масс имеет вид:
закон действующих масс имеет вид: .
. ,
, и
и 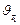 – скорости реакции при температурах
– скорости реакции при температурах 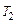 и
и  соответственно;
соответственно; – температурный коэффициент скорости реакции.
– температурный коэффициент скорости реакции.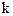 (из уравнения закона действующих масс).
(из уравнения закона действующих масс). ,
, – предэкспоненциальный множитель, который определяется числом столкновений и ориентацией реагирующих веществ;
– предэкспоненциальный множитель, который определяется числом столкновений и ориентацией реагирующих веществ;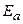 – энергия активации, кДж/моль;
– энергия активации, кДж/моль;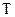 – абсолютная температура, К;
– абсолютная температура, К;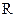 – 8,314 Дж/моль·К – универсальная газовая постоянная;
– 8,314 Дж/моль·К – универсальная газовая постоянная; – основание натурального логарифма (2,718…).
– основание натурального логарифма (2,718…). , то реакция называется эндотермической.
, то реакция называется эндотермической. ;
;  ,
, – константа равновесия, которая зависит от природы реагирующих веществ и температуры и не зависит от их концентрации и наличия катализаторов.
– константа равновесия, которая зависит от природы реагирующих веществ и температуры и не зависит от их концентрации и наличия катализаторов. ). Следовательно, направление смещения равновесия зависит от знака ΔН.
). Следовательно, направление смещения равновесия зависит от знака ΔН.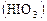 и сернистая
и сернистая 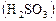 кислоты, которые реагируют между собой:
кислоты, которые реагируют между собой: .
. ,
,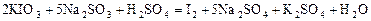 ,
, .
.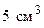 воды, в третий – 10 см3 воды и т.д. в соответствии с данными таблицы 1.
воды, в третий – 10 см3 воды и т.д. в соответствии с данными таблицы 1.


 , с
, с
 ,
, 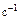
 , а в другую – из первого микростакана внесите 20 капель раствора Б (первый вариант концентраций) и быстро слейте жидкость из первой пробирки во вторую, одновременно включив секундомер. Отметьте и запишите время полного изменения раствором окраски (синий цвет). Такие же опыты проделайте для других вариантов концентраций раствора Б.
, а в другую – из первого микростакана внесите 20 капель раствора Б (первый вариант концентраций) и быстро слейте жидкость из первой пробирки во вторую, одновременно включив секундомер. Отметьте и запишите время полного изменения раствором окраски (синий цвет). Такие же опыты проделайте для других вариантов концентраций раствора Б.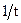 , обратно пропорциональную времени протекания реакции.
, обратно пропорциональную времени протекания реакции.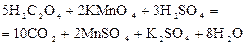 ,
, .
. восстанавливается в ион
восстанавливается в ион  , в результате чего изменяется цвет раствора: из красно-фиолетового (цвет иона
, в результате чего изменяется цвет раствора: из красно-фиолетового (цвет иона  концентрации 0,1 моль/дм3; раствор Б – раствор
концентрации 0,1 моль/дм3; раствор Б – раствор  и серной кислоты.
и серной кислоты. , с
, с
 ,
, 
 и определите, в каком случае скорость больше и во сколько раз. Сделайте вывод о значении поверхности соприкосновения реагирующих веществ в гетерогенных процессах. Напишите уравнение реакции и математическое выражение основного закона химической кинетики.
и определите, в каком случае скорость больше и во сколько раз. Сделайте вывод о значении поверхности соприкосновения реагирующих веществ в гетерогенных процессах. Напишите уравнение реакции и математическое выражение основного закона химической кинетики. . Реакция обратима:
. Реакция обратима: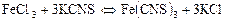 .
. ,
, йодокрахмал
йодокрахмал  .
.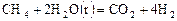 ;
;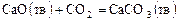 .
.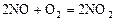 :
: в 2 раза?
в 2 раза?
 :
: ); сульфат натрия кристаллогидрат (
); сульфат натрия кристаллогидрат ( ); раствор серной кислоты (
); раствор серной кислоты ( ); дистиллированная вода.
); дистиллированная вода.


