
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила техники безопасности и пожарнойСодержание книги Поиск на нашем сайте
ХИМИЯ
Методические указания к лабораторным работам для студентов специальности 1-45 01 03 Сети телекоммуникаций
Минск УДК 54 ББК 24я721 Х46
Рекомендовано к изданию кафедрой математики и физики 27 декабря 2009, протокол № 5
Составитель Г. И. Ласько, преподаватель высшей категории кафедры математики и физики
Рецензент О. В. Твердохлебова, преподаватель I категории кафедры математики и физики
Учебной программой предусмотрено выполнение четырех четырехчасовых лабораторных работ по темам: «Скорость химических реакций и химическое равновесие», «Растворы», «Окислительно-восстановительные реакции», «Коррозия металлов и методы защиты от коррозии». В результате выполнения лабораторных работ студенты должны знать основные закономерности протекания изученных физико-химических процессов, уметь использовать полученные знания для решения конкретных практических задач, приобрести навыки постановки и проведения химического эксперимента.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ И ПОЖАРНОЙ БЕЗОПАСНОСТИ В ЛАБОРАТОРИИ ХИМИИ Общие требования безопасности 1. Допуск к работе в лаборатории разрешается только после прохождения вводного инструктажа, ознакомления с инструкцией по технике безопасности и пожарной безопасности и инструктажа на рабочем месте. 2. Необходимо сделать запись в журнале регистрации инструктажей на рабочем месте с обязательными подписями инструктируемого и инструктирующего, с указанием даты и номера инструктажа. 3. Каждый студент должен знать и всегда выполнять правила техники безопасности и пожарной безопасности, правила технической эксплуатации приборов и обращения с химическими реактивами. 4. К опасным производственным факторам в лаборатории химии относятся: кислоты, щелочи, спиртовки, легковоспламеняющиеся вещества, стеклянная посуда, а также наличие напряжения 220 В с частотой 50 Гц. 5. Лаборатория должна быть обеспечена медицинской аптечкой, содержащей все необходимое для оказания первой помощи при тепловых, химических и иных травмах. В случае ожога или травмирования немедленно сообщить преподавателю или лаборанту, а при необходимости оказать первую медицинскую помощь, вызвать врача по телефону 103. Требования безопасности перед началом работ
1. Осмотреть рабочее место, приборы, оборудование, химические реактивы и подготовить рабочее место. 2. Ознакомиться с инструкциями пользования приборами и применения химических реактивов для каждой работы. 3. Знать свойства веществ, загрязняющих посуду.
Правила безопасности при выполнении работ
1. Работая в химической лаборатории, необходимо соблюдать исключительную осторожность. Помнить, что неаккуратность, невнимательность, недостаточное знакомство с приборами и свойствами химических веществ могут повлечь за собой несчастный случай (порезы, ожоги, слепоту, поражение электрическим током). 2. Рабочее место необходимо содержать в образцовом порядке и чистоте, не загромождать ненужными в данный момент вещами (сумками, головными уборами и т.д.) 3. Приступать к выполнению задания только после разрешения преподавателя. 4. Химические реакции выполнять с такими количествами и концентрациями веществ, в такой посуде и приборах, как это указано в соответствующем разделе руководства. 5. Производить опыты в чистой посуде. 6. Продукты химических реакций сливать только в специальные банки. 7. Бумагу, фильтры, битую посуду выбрасывать только в специальные мусорные ведра. 8. Все опыты, сопровождающиеся выделением ядовитых, летучих и неприятно пахнущих веществ (например, выпаривание, кипячение растворов кислот, а также растворов, содержащих галогены, аммиак, сероводород и т.п.), проводить только в вытяжном шкафу. 9. Выполняя опыты со взрывчатыми, легко воспламеняющимися веществами или концентрированными кислотами и щелочами, помимо соблюдения всех других мер предосторожности, работать стоя. Поджигать выделяющиеся газы и пары можно только после предварительной проверки их на чистоту, так как смесь горючего газа с воздухом взрывоопасна. 10. Наливая или нагревая реактивы, не наклоняться над сосудом, так как возможно разбрызгивание и даже выброс жидкости. Нагревая пробирки, колбы, стаканы, не держать их отверстием к себе или в сторону находящихся рядом студентов. 11. При пользовании реактивами соблюдать чистоту и особую аккуратность: – внимательно читать надпись на этикетке, прежде чем взять вещество для опыта; – закрывая склянки, не перепутать пробки, так как при этом реактивы загрязняются и становятся непригодными для работы; – излишек взятого реактива не высыпать и не выливать обратно в сосуд, из которого он был взят, так как таким образом можно загрязнить все содержимое; – реактивы общего пользования не уносить на рабочее место, соблюдать порядок расстановки как реактивов общего пользования, так и реактивов на рабочих столах; – склянки с растворами при взятии из них реактива держать так, чтобы этикетка всегда находилась сверху и раствор не попадал на нее; – во всех случаях (за исключением тех, когда указано точное количество) брать минимальное количество реактивов: 1-2 см3; – категорически запрещается пробовать реактивы на вкус, так как многие из них ядовиты. 12. Во избежание отравлений запрещается пользоваться какой-либо химической посудой для питья. 13. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе. 14. При разбавлении водой концентрированных кислот, особенно серной и азотной, нельзя приливать воду к кислоте. Нужно приливать тонкой струйкой кислоту к воде при перемешивании. Приготовлять растворы нужно только в тонкостенной стеклянной или фарфоровой посуде. 15. При работе постоянно следить за тем, чтобы реактивы (особенно кислоты и щелочи) не попадали на лицо, руки, одежду, химический стол и пол. Работать с реактивами следует над кюветкой. 16. Горячие предметы ставить только на теплоизоляционные подставки (асбестовая сетка, керамическая плитка и т.д.) 17. Держать дальше от огня легковоспламеняющиеся вещества: эфир, бензин, спирт и др. Если воспламенится бензин, спирт или эфир, надо немедленно накрыть пламя асбестом или засыпать песком. Требования безопасности по окончании работ
1. Все приборы отключить от сети. 2. Привести в порядок рабочее место, вымыть посуду, закрыть реактивы и сдать лаборанту или преподавателю. 3. Тщательно вымыть руки с мылом и вытереть их.
Меры пожарной безопасности
1. В случае возникновения пожара в лаборатории все огнеопасные или взрывчатые вещества должны быть убраны в безопасное место, которое следует особо предохранять от пламени. 2. Нужно помнить, что горящие нерастворимые в воде вещества, особенно жидкости (бензол, бензин и т.п.), тушить водой нельзя. 3. Работающим в лаборатории необходимо ознакомиться с инструкцией по использованию огнетушителем, обычно написанной на каждом из них. Огнетушитель должен висеть так, чтобы к нему был обеспечен свободный доступ. 4. О всех нарушениях правил пожарной безопасности сообщать руководителю работ. В случае возникновения пожара немедленно начать эвакуацию людей из лаборатории, принять меры по ликвидации пожара, поставить в известность пожарную службу. Вызов пожарной команды 101. 5. За нарушение правил и норм пожарной безопасности виновные несут ответственность в соответствии с законодательством Республики Беларусь. ЛАБОРАТОРНАЯ РАБОТА № 1 Краткие теоретические сведения
Скорость химических реакций Учение о механизме и скорости протекания химических реакций называется химической кинетикой. При рассмотрении вопроса о скорости химических реакций необходимо различать реакции, протекающие в гомогенной или гетерогенной системах. Системой в химии называют рассматриваемое вещество или совокупность веществ. Система отделена от внешней среды. Гомогенной называют систему, состоящую из одной фазы. Она может быть в газообразном (воздух), жидком (морская вода) или твердом состояниях. Гетерогенной называют систему, состоящую из нескольких фаз, например вода со льдом. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства меняются скачкообразно. Реакции, протекающие в гомогенной системе, называются гомогенными, а в гетерогенной системе – гетерогенными. Примером гомогенной реакции может быть любая реакция, протекающая в растворе:
Гомогенные реакции протекают во всем объеме системы. Гетерогенные реакции идут только на поверхности раздела фаз, образующих эту систему, например:
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. В гомогенной системе реакционным пространством является объем. Отношение количества вещества к единице объема называется концентрацией С. Скоростью гомогенной химической реакции называют изменение концентрации вещества в единицу времени. Если в момент времени
Если Если Истинная скорость реакции
Реакционным пространством в гетерогенной реакции является поверхность раздела фаз, поэтому скоростью гетерогенной реакции называется изменение количества вещества в единицу времени на единице площади поверхности раздела фаз:
или через производную:
где Скорость химической реакции определяется следующими основными факторами: 1) природой реагирующих веществ; 2) концентрацией реагирующих веществ; 3) температурой протекания реакции; 4) наличием катализаторов, механизмом реакции и т.д. Зависимость скорости химической реакции от концентрации выражается законом действующих масс, основным законом химической кинетики: при постоянной температуре скорость гомогенной химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степени их стехиометрических коэффициентов. Для химических реакций в общем виде
где Этот коэффициент зависит от природы реагирующих веществ, температуры и наличия катализаторов. Величина этого коэффициента не зависит от концентрации веществ, участвующих в реакции. Для гетерогенных химических реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе, а также площадь поверхности раздела фаз. Концентрация вещества, находящегося в твердой фазе, обычно постоянна и входит в константу скорости. Например, для реакции горения угля
Зависимость скорости химической реакции от температуры определяется приближенным правилом Вант-Гоффа: при повышении температуры на каждые 10º скорость химической реакции увеличивается в 2-4 раза:
где
Величина При концентрации реагирующих веществ 1 моль/дм3 скорость реакции численно равна константе скорости Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса:
где
Энергия активации – это энергия, необходимая для перевода молекул из неактивного состояния в активное, столкновения которых приводят к химическим взаимодействиям. Энергия активации зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше скорость реакции. Энергия активации необходима для ослабления химических связей в исходных веществах и для преодоления отталкивания между электронами при сближении молекул и атомов взаимодействующих веществ. Другими словами, для образования неустойчивого активированного комплекса, который распадается с образованием продуктов реакции. Химические реакции сопровождаются тепловыми эффектами. Если тепловой эффект реакции ΔН < 0, то реакция идет с выделением энергии в окружающую среду, т.е. экзотермическая. Если реакция идет с поглощением энергии из окружающей среды Катализаторы – это вещества, которые ускоряют химические реакции, но не испытывают химических превращений в их результате, т.е. восстанавливают свой состав. Явление изменения скорости химической реакции под воздействием катализаторов называется катализом. Катализаторы снижают энергию активации за счет изменения механизма химических реакций.
Химическое равновесие Все химические реакции можно классифицировать как обратимые и необратимые. Состояние системы, при котором скорости прямой и обратной реакции равны, называется химическим равновесием. Кинетическое химическое равновесие является динамическим: одновременно протекают прямая и обратная реакции. Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ реакции. Для любой обратимой реакции в состоянии равновесия выполняется соотношение:
где Константа равновесия химической реакции показывает глубину превращения исходных веществ в продукты реакции. Для обратимых реакций по величине константы равновесия можно определить величину выхода продуктов реакции. Химическое равновесие зависит от параметров состояния системы и существует при строго определенных значениях концентрации, температуры и давления. При изменении хотя бы одного из параметров равновесие смещается в левую или правую сторону. Направление смещения химического равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия. Увеличение концентрации исходных веществ приводит к смещению равновесия в сторону образования продуктов реакции. При повышении давления (для газов и паров) равновесие смещается в сторону той реакции, при которой наблюдается уменьшение объема системы (в сторону образования меньшего числа молекул); если реакция протекает без изменения объема, то изменение давления не приводит к смещению химического равновесия. При повышении температуры равновесие смещается в сторону протекания эндотермической реакции (
Экспериментальная часть
Опыт 1. Исследование зависимости скорости реакции от концентрации реагирующих веществ. Зависимость скорости реакции от концентрации реагирующих веществ рассмотрим на примере взаимодействия растворов йодата калия ( При взаимодействии раствора йодата калия, содержащего крахмал, сначала образуется йодноватая
Эта реакция протекает медленно. Когда вся сернистая кислота израсходуется, йодноватая кислота реагирует с йодоводородной кислотой:
а выделяющийся йод в присутствии крахмала окрашивает раствор в синий цвет. Это вторая стадия реакции. Суммарное уравнение реакции имеет вид:
или в ионной форме:
Время протекания реакции с момента сливания растворов до появления синего окрашивания отсчитывайте по секундомеру. Для проведения опыта используйте следующие реактивы: - раствор А – раствор йодата калия ( - раствор Б – раствор сульфита натрия Приготовьте 7 чистых и сухих пробирок, 5 микростаканов и две капельные пипетки. Концентрация раствора А остается постоянной, а из раствора Б приготовьте 5 различных концентраций. Для этого в 5 пронумерованных микростаканов налейте из банки по 10 см3 раствора Б. Затем прилейте в микростаканы необходимое количество дистиллированной воды. В первый стакан воду не приливайте (концентрация раствора Б остается той же), во второй микростакан прилейте
Таблица 1 – Зависимость скорости реакции от концентрации реагирующих веществ
В одну из пробирок внесите с помощью капельной пипетки 20 капель раствора Результат опытов запишите в таблицу 1. Для каждого варианта вычислите относительную скорость реакции По полученным данным постройте график зависимости скорости реакции от концентрации. По оси абсцисс отложите значения концентраций раствора сульфита натрия, а по оси ординат – относительную скорость В результате получается параболическая кривая, показывающая степенную зависимость скорости реакции от концентрации. Эта кривая является наглядным подтверждением основного закона химической кинетики. Опыт 2. Исследование зависимости скорости реакции от температуры. Для изучения влияния температуры на скорость химической реакции используется реакция окисления щавелевой кислоты перманганатом калия в присутствии серной кислоты:
или в ионной форме:
В кислой среде ион Опыт проводите в четырех вариантах при разных температурах, как указано в таблице 2. Раствор А – раствор Налейте по 10 капель растворов А и Б в две конические пробирки. Слейте эти растворы в одну пробирку и отсчитывайте время с момента смешения до обесцвечивания раствора, запишите в таблицу 2.
Таблица 2
Т* – комнатная температура.
Затем выполняйте второй вариант опыта, для этого надо взять в две конические пробирки по 10 капель раствора А и Б. Нагрейте эти растворы в течение 5-7 минут в термостате, в котором установлена температура, на 10º превышающая комнатную, или в водяной бане, температуру которой определите по термометру, вставленному в одно из отверстий в крышке. Достаньте пробирку с раствором Проведите опыты при других значениях температуры. Результаты опытов запишите в таблицу 2. По полученным данным постройте график зависимости скорости реакции от температуры. По оси абсцисс отложите значения температуры в градусах Кельвина, а по оси ординат – скорость реакции. Опыт 3. Исследование влияния величины поверхности реагирующих веществ на скорость в гетерогенной системе. Взвесьте на электронных весах кусочек мрамора массой примерно 0,1 г и мрамор в виде порошка такой же массы. В две конические пробирки налейте по 10 капель разбавленной соляной кислоты. Внесите одновременно обе навески мрамора в пробирки с кислотой: кусочек внесите в одну пробирку, порошок – в другую. В какой пробирке реакция протекает быстрее? Заметьте время, которое потребовалось для полного растворения мрамора. Вычислите для обоих случаев относительную скорость Опыт 4. Исследование влияния концентрации реагирующих веществ на химическое равновесие. К 10 каплям раствора хлорида железа (III) концентрации 0,01 моль/дм3 прибавьте 10 капель раствора роданида калия концентрации 0,02 моль/дм3. В результате получается раствор с характерной красной окраской, обусловленной присутствием роданида железа (III)
Для ослабления окраски раствора в пробирку добавьте 5-7 см3 дистиллированной воды. Полученный раствор красного цвета разлейте поровну в четыре конических пробирки. Первую пробирку оставьте для сравнения. Во вторую добавьте несколько капель насыщенного раствора хлорида железа (III). В третью пробирку добавьте несколько капель насыщенного раствора роданида калия. Перемешайте растворы в пробирках. В четвертую пробирку добавьте сухую соль хлорида калия и энергично перемешайте стеклянной палочкой. Наблюдайте и запишите изменение окраски раствора в каждой пробирке. Пользуясь выражением для константы химического равновесия:
объясните изменение окраски растворов во всех пробирках. Опыт 5. Исследование влияния температуры на химическое равновесие. Реакция взаимодействия крахмала с йодом является обратимой и протекает с образованием йодокрахмала (соединение синего цвета) и выделением теплоты. Схематично эту реакцию можно изобразить следующим образом: Йод + крахмал В две пробирки налейте по 4-5 см3 раствора крахмала и добавьте 5-10 капель раствора йода концентрации 0,005 моль/дм3 (до появления окраски синего цвета). Нагревая и охлаждая одну из пробирок, наблюдайте за изменением окраски. Сделайте вывод о влиянии температуры на смещение химического равновесия.
Содержание отчета
1. Название и цель работы. 2. Используемые реактивы, посуда и оборудование. 3. Записать в отчет краткие теоретические сведения. 4. При оформлении первого опыта приведите уравнения химических реакций. Результаты опытов запишите в таблицу 1, рассчитайте скорость реакции для каждого опыта и заполните таблицу 1. Постройте график зависимости скорости реакции от концентрации сульфита натрия. 5. При оформлении второго опыта приведите уравнение химической реакции. Результаты опытов запишите в таблицу 2 и заполните ее. Постройте график зависимости скорости реакции от температуры, вычислите температурный коэффициент скорости реакции. 6. Для третьего опыта приведите уравнение химической реакции и математическое выражение основного закона химической кинетики. Запишите наблюдения, сделайте вывод о влиянии площади поверхности реагирующих веществ на скорость реакции, протекающей в гетерогенной среде. 7. Запишите наблюдения о влиянии компонентов реакции на смещение равновесия, объясните изменение окраски в каждой из пробирок, используя выражение константы химического равновесия для этой реакции. Сделайте выводы о влиянии температуры на смещение химического равновесия.
Контрольные вопросы
1. Сформулируйте закон действующих масс. Напишите уравнение этого закона для следующих реакций: а) б) 2. Каков физический смысл константы скорости химической реакции? От каких факторов она зависит? 3. Как изменится скорость химической реакции а) если увеличить концентрацию б) если уменьшить объем системы в 2 раза? в) если увеличить давление в 2 раза? 4. Какие реакции называются обратимыми? Каков физический смысл константы равновесия? Как повлияет на смещение равновесия реакции а) повышение температуры? б) уменьшение давления?
ЛАБОРАТОРНАЯ РАБОТА № 2 РАСТВОРЫ
Цель работы: приобрести навыки приготовления растворов заданных количественных составов. Приборы: электронные весы, набор ареометров. Реактивы: бихромат калия ( Посуда: химические стаканы на 100 см3, цилиндры, стеклянные воронки и палочки, мерные колбы на 100 см3, часовые стекла.
Экспериментальная часть
Опыт 1. Приготовление раствора бихромата калия (или другой соли) с заданной массовой долей. Рассчитайте, какую массу бихромата калия На электронных весах (с точностью до 0,01 г) определите массу часового стекла и взвесьте на нем вычисленное количество бихромата калия (или другой соли). Отмерьте мензуркой необходимый объем дистиллированной воды. Навеску соли перенесите в стакан емкостью 100 см3. При этом стеклышко обмойте над стаканом небольшим количеством воды из мензурки. Смесь перемешайте до полного растворения кристаллов соли и перенесите в цилиндр. Определите ареометром плотность приготовленного раствора. Раствор сдайте лаборанту. Все результаты взвешиваний и расчетов запишите в отчет. По таблице 4 найдите массовую долю бихромата калия (или другой соли) в растворе. Установите величину расхождения найденной массовой доли с заданной. Вычислите молярную концентрацию Опыт 2. Приготовление раствора сульфата натрия с заданной молярной концентрацией. Рассчитайте, какую массу кристаллогидрата сульфата натрия На электронных весах отвесьте вычисленное количество сульфата натрия на часовом стекле. В мерную колбу емкостью 100 см3 вставьте воронку диаметром 3,5 см с обрезанным концом. Навеску соли перенесите в колбу. Небольшим количеством дистиллированной воды из мензурки обмойте над воронкой часовое стекло и смойте всю соль в колбу. Постепенно добавляя воду и перемешивая жидкость легкими круговыми движениями, добейтесь полного растворения сульфата натрия в колбе. Объем воды при этом не должен превышать 2/3 объема колбы. После растворения всей соли добавьте воду в колбу до метки. Последние порции воды следует добавлять по каплям из пипетки. Уровень жидкости следует определять по нижнему краю мениска над меткой. Плотно закройте колбу пробкой и перемешайте раствор, несколько раз перевернув колбу вверх дном (4-5 раз). Приготовленный раствор вылейте в цилиндр, измерьте ареометром его плотность и по этой величине найдите массовую долю сульфата натрия в растворе (таблица 5). Раствор сдайте лаборанту. Запишите в отчет порядок и результаты расчета, а также методику приготовления раствора.
Опыт 3. Приготовление раствора серной кислоты с заданной молярной концентрацией. Налейте имеющуюся в лаборатории серную кислоту (массовая доля 0,1-0,15) в цилиндр, определите ареометром ее плотность. Какой массовой доле соответствует найденное значение плотности раствора серной кислоты (таблица 3)? Рассчитайте, какой объем этой кислоты нужно взять для приготовления 100 см3 раствора серной кислоты заданной молярной концентрации. Отмерьте этот объем мерным цилиндром. В мерную колбу емкостью 100 см3 налейте из промывалки дистиллированную воду до
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 374; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.15.34 (0.015 с.) |

 ,
,  .
. .
. концентрация реагирующего вещества была
концентрация реагирующего вещества была  (моль/дм3), а в последующий момент времени
(моль/дм3), а в последующий момент времени  оказалась равной
оказалась равной  (моль/дм3), то средняя скорость реакции будет выражаться отношением:
(моль/дм3), то средняя скорость реакции будет выражаться отношением: ;
;  – тау.
– тау.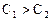 , то
, то  – правая часть уравнения будет отрицательной.
– правая часть уравнения будет отрицательной. , то
, то  – правая часть уравнения будет положительной.
– правая часть уравнения будет положительной.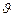 в данный момент времени определяется как первая производная от концентрации по времени:
в данный момент времени определяется как первая производная от концентрации по времени: , моль/дм3·с.
, моль/дм3·с.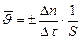 , моль/с·м2,
, моль/с·м2, ,
, – площадь поверхности раздела фаз;
– площадь поверхности раздела фаз;  и
и 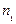 – количество реагирующего вещества в момент времени
– количество реагирующего вещества в момент времени  – изменение количества реагирующего вещества за промежуток времени
– изменение количества реагирующего вещества за промежуток времени  .
. кинетическое уравнение химической реакции будет иметь вид:
кинетическое уравнение химической реакции будет иметь вид: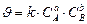 ,
,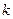 – коэффициент пропорциональности, называемый константой скорости химической реакции, дм3/моль·с.
– коэффициент пропорциональности, называемый константой скорости химической реакции, дм3/моль·с. закон действующих масс имеет вид:
закон действующих масс имеет вид: .
. ,
, и
и 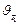 – скорости реакции при температурах
– скорости реакции при температурах 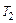 и
и  соответственно;
соответственно; – температурный коэффициент скорости реакции.
– температурный коэффициент скорости реакции.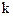 (из уравнения закона действующих масс).
(из уравнения закона действующих масс). ,
, – предэкспоненциальный множитель, который определяется числом столкновений и ориентацией реагирующих веществ;
– предэкспоненциальный множитель, который определяется числом столкновений и ориентацией реагирующих веществ;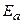 – энергия активации, кДж/моль;
– энергия активации, кДж/моль;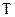 – абсолютная температура, К;
– абсолютная температура, К;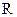 – 8,314 Дж/моль·К – универсальная газовая постоянная;
– 8,314 Дж/моль·К – универсальная газовая постоянная; – основание натурального логарифма (2,718…).
– основание натурального логарифма (2,718…). , то реакция называется эндотермической.
, то реакция называется эндотермической. ;
;  ,
, – константа равновесия, которая зависит от природы реагирующих веществ и температуры и не зависит от их концентрации и наличия катализаторов.
– константа равновесия, которая зависит от природы реагирующих веществ и температуры и не зависит от их концентрации и наличия катализаторов. ). Следовательно, направление смещения равновесия зависит от знака ΔН.
). Следовательно, направление смещения равновесия зависит от знака ΔН. ) и сульфита натрия
) и сульфита натрия  в присутствии серной кислоты и крахмала.
в присутствии серной кислоты и крахмала.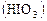 и сернистая
и сернистая 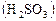 кислоты, которые реагируют между собой:
кислоты, которые реагируют между собой: .
. ,
,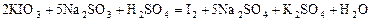 ,
, .
.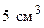 воды, в третий – 10 см3 воды и т.д. в соответствии с данными таблицы 1.
воды, в третий – 10 см3 воды и т.д. в соответствии с данными таблицы 1.


 , с
, с
 ,
, 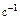
 , а в другую – из первого микростакана внесите 20 капель раствора Б (первый вариант концентраций) и быстро слейте жидкость из первой пробирки во вторую, одновременно включив секундомер. Отметьте и запишите время полного изменения раствором окраски (синий цвет). Такие же опыты проделайте для других вариантов концентраций раствора Б.
, а в другую – из первого микростакана внесите 20 капель раствора Б (первый вариант концентраций) и быстро слейте жидкость из первой пробирки во вторую, одновременно включив секундомер. Отметьте и запишите время полного изменения раствором окраски (синий цвет). Такие же опыты проделайте для других вариантов концентраций раствора Б.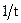 , обратно пропорциональную времени протекания реакции.
, обратно пропорциональную времени протекания реакции.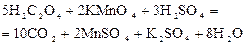 ,
, .
. восстанавливается в ион
восстанавливается в ион  , в результате чего изменяется цвет раствора: из красно-фиолетового (цвет иона
, в результате чего изменяется цвет раствора: из красно-фиолетового (цвет иона  концентрации 0,1 моль/дм3; раствор Б – раствор
концентрации 0,1 моль/дм3; раствор Б – раствор  и серной кислоты.
и серной кислоты. , с
, с
 ,
, 
 . Перелейте ее содержимое в пробирку с раствором щавелевой кислоты. Не вынимая пробирку из термостата, определите время завершения реакции.
. Перелейте ее содержимое в пробирку с раствором щавелевой кислоты. Не вынимая пробирку из термостата, определите время завершения реакции. и определите, в каком случае скорость больше и во сколько раз. Сделайте вывод о значении поверхности соприкосновения реагирующих веществ в гетерогенных процессах. Напишите уравнение реакции и математическое выражение основного закона химической кинетики.
и определите, в каком случае скорость больше и во сколько раз. Сделайте вывод о значении поверхности соприкосновения реагирующих веществ в гетерогенных процессах. Напишите уравнение реакции и математическое выражение основного закона химической кинетики. . Реакция обратима:
. Реакция обратима: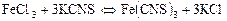 .
. ,
, йодокрахмал
йодокрахмал  .
.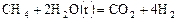 ;
;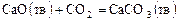 .
.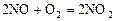 :
: в 2 раза?
в 2 раза?
 :
: ); сульфат натрия кристаллогидрат (
); сульфат натрия кристаллогидрат ( ); раствор серной кислоты (
); раствор серной кислоты ( ); дистиллированная вода.
); дистиллированная вода. ) нужно взять для приготовления 100 г раствора с заданной массовой долей. Какой объем воды следует при этом взять?
) нужно взять для приготовления 100 г раствора с заданной массовой долей. Какой объем воды следует при этом взять? нужно взять для приготовления 100 см3 раствора этой соли заданной концентрации.
нужно взять для приготовления 100 см3 раствора этой соли заданной концентрации. части объема колбы. Перемешивая жидкость в колбе круговыми движениями, через воронку понемногу перелейте в нее всю кислоту из мерного цилиндра. Сполосните воронку водой, достаньте ее и дожди
части объема колбы. Перемешивая жидкость в колбе круговыми движениями, через воронку понемногу перелейте в нее всю кислоту из мерного цилиндра. Сполосните воронку водой, достаньте ее и дожди 


