
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции межмолекулярного окисления-восстановленияСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Опыт 1. Восстановление ионов меди металлическим железом. Налейте в пробирку 3-5 см3 раствора CuSO4 и поместите туда железную проволоку. Что наблюдается? Составьте уравнение происходящей реакции и схемы ионных процессов. Опыт 2. Окислительные свойства перманганата калия (КMnO4). Налейте в три пробирки по 2-3 см3 раствора перманганата калия. В одну из них добавьте 3-4 капли раствора серной кислоты концентрации 1 моль/дм3, в другую – столько же воды, а в третью – такое же количество раствора щелочи. Затем внесите во все пробирки по микрошпателю сульфита натрия (Na2SO3 кр.). Наблюдайте обесцвечивание раствора перманганата в первой пробирке, выпадение бурого осадка во второй и образование зеленого раствора в третьей:
Чем объясняется различие продуктов при взаимодействии одних и тех же веществ? Опыт 3. Окислительные свойства бихромата калия (К2Сr2O7). Налейте в пробирку 1-2 см3 раствора бихромата калия, добавьте 2-3 капли серной кислоты и микрошпатель сульфата железа (II) (FeSO4 кр). Объясните переход оранжевой краски раствора в зеленую. Используя метод полуреакций, составьте полное уравнение реакции, указав окислитель и восстановитель.
Опыт 4. Окислительные свойства пероксида водорода. Налейте в пробирку 1-2 см3 раствора иодида калия и добавьте 3-4 капли раствора пероксида водорода. Что наблюдается? Составьте структурную формулу пероксида водорода и определите степень окисления кислорода в этом соединении, напишите уравнение реакции. Опыт 5. Оксилительно-восстановительные свойства азотистой кислоты. Внимание! Опыт проводить под вытяжкой! Налейте в пробирку 1-2 см3 раствора иодида калия, 3-4 капли раствора нитрата натрия и несколько капель раствора Н2SO4 (для создания кислой среды). Что наблюдаете? В другую пробирку налейте 1-2 см3 раствора перманганата калия, подкислите раствором H2SO4 и добавьте 3-4 капли раствора нитрата натрия. Что наблюдаете? Используя метод полуреакций, составьте полные уравнения реакций:
Определите окислитель и восстановитель в данных реакциях. Опыт 6. Восстановительные свойства органических веществ. В коническую пробирку налейте 2-3 см3 раствора бихромата калия, осторожно добавьте 2 см3 концентрированной серной кислоты (
Испытайте на запах образующийся этаналь (СН3СНО). Напишите уравнение реакции с учетом окисления спирта в этаналь.
Реакции внутримолекулярного окисления-восстановления Поместите в пробирку такое количество КMnO4 кр, чтобы оно покрыло дно. Нагрейте содержимое пробирки над спиртовкой и с помощью тлеющей лучины определите выделение кислорода. Методом электронного баланса составьте уравнение реакции, зная, что в результате реакции образовались молекулярный кислород, диоксид марганца и манганат калия (К2MnO4).
Реакции самоокисления-самовосстановления (диспропорционирования) Внимание! Опыт проводить под вытяжкой! Налейте в пробирку 1-2 см3 раствора нитрита натрия, добавьте 3-4 капли раствора серной кислоты концентрации 1 моль/см3. Что наблюдается? Используя метод полуреакций, составьте полное уравнение реакции:
Что происходит с оксидом азота (II) на воздухе?
Содержание отчета 1. Название и цель работы. 2. Используемые посуда, реактивы и оборудование. 3. Запишите в отчет краткие теоретические сведения. 4. Расставьте коэффициенты в ОВР методами, указанными в опытах. Приведите полные уравнения химических реакций. 5. Выводы.
Контрольные вопросы 1. Почему все металлы проявляют только восстановительные свойства, а многие неметаллы могут быть и окислителями, и восстановителями? Приведите примеры. 2. Какие свойства в ОВР будет проявлять сера, находясь в степени окисления (0), (-2), (+4)? 3. Составьте уравнения реакций: а) КI + K2Cr2O7 + H2SO4 = б) FeSO4 + H2O2 + H2SO4 = 4. К какому типу ОВР относится реакция: NH4NO2 = N2 + 2 H2O? Методом электронного баланса расставьте коэффициенты в данном уравнении. ЛАБОРАТОРНАЯ РАБОТА № 4 КОРРОЗИЯ МЕТАЛЛОВ И МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ Цель работы: исследовать основные виды коррозии и методы защиты металлов от коррозии на конкретных опытах. Реактивы: раствор серной кислота (H2SO4) концентрации 0,5 моль/дм3; цинк; медь; раствор сульфата меди (CuSO4
Посуда: U-образные трубки, стеклянные стаканы на 50 см3, пробирки, пипетки. Оборудование: ячейка для электролиза с угольным и стальным электродами, источник питания постоянного тока, шпатели, пинцеты, штативы для пробирок.
|
||||||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 722; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.134.159 (0.009 с.) |


 .
.
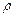 = = 1,84 г/см3), затем 3 см3 этилового спирта (С2Н5ОН). Наблюдайте изменения окраски раствора.
= = 1,84 г/см3), затем 3 см3 этилового спирта (С2Н5ОН). Наблюдайте изменения окраски раствора.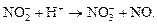
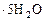 ) концентрации 0,1 моль/дм3; алюминий; раствор с массовой долей хлорида натрия (NaCl), равной 0,03; раствор гексацианоферрат (III) калия (К3 [Fe(CN)6]) концентрации 0,01 моль/дм3; оцинкованное железо, луженое железо; раствор уксусной кислоты (CH3COOH) концентрации 0,1 моль/ дм3; раствор иодида калия (КI) концентрации 0,1 моль/ дм3; свинец.
) концентрации 0,1 моль/дм3; алюминий; раствор с массовой долей хлорида натрия (NaCl), равной 0,03; раствор гексацианоферрат (III) калия (К3 [Fe(CN)6]) концентрации 0,01 моль/дм3; оцинкованное железо, луженое железо; раствор уксусной кислоты (CH3COOH) концентрации 0,1 моль/ дм3; раствор иодида калия (КI) концентрации 0,1 моль/ дм3; свинец.


