
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация химических реакцийСодержание книги
Поиск на нашем сайте
Все многообразие химических процессов можно разделить на два типа
1. Реакции, протекающие без изменения степени окисления элементов, входящих в состав реагирующих веществ. Например: а) Ca(OH)2 + 2CO2 = Ca(HCO3)2 реакция соединения; б) NaOH + HCl = NaСl+H2O реакция обмена; в) CaCO3 = CaO + CO2 реакция разложения. Сохранение степени окисления показывает, что электронные оболочки атомов в реакциях данного типа претерпевают незначительные изменения. Ни один из атомов или ионов не теряет и не приобретает электронов. Такие реакции называются электростатическими.
2. Реакции, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ:
а) все реакции замещения:
Zn0+H21+SO4 = Zn2+SO4+H20 ;
б) реакции соединения, в которых участвует хотя бы одно простое вещество: Fe0+S0 = Fe2+S2-, 2 FeCl2+Cl2 = 2 FeCl3;
в) реакции разложения, когда требуется хотя бы одно простое вещество: 2Ag+2O = 4Ag+O2
и многие другие реакции, например,
Mn4+O2+4HСl-1 = Mn2+Cl2+Cl20+2H2O.
Изменение степени окисления связано с потерей или приобретением электронов. Поэтому реакции данного типа называются электронно-динамическими. Современная классификация – по донорно-акцепторному механизму: а) электрон-донорно-акцепторные – это окислительно-восстанови-тельные реакции; б) протон-донорно-акцепторные – кислотно-основное взаимодействие по Бренстеду-Лоури; в) партикуло-донорно-акцепторные – реакции комлексообразования . Все химические реакции, в которых электроны переходят от одного вещества или его части к другому веществу или к другой части одного и того же вещества, называются окислительно-восстановительными, или red -ox (редокс) процессами.
потеря электронов, т. е. приобретение электронов, т. е. повышение степени окисления понижение степени окисления Окилитель Восстановитель присоединяет электроны, сам отдает электроны, сам окисляется, восстанавливается, понижает повышает своею степень окисления свою степень окисления
Любому веществу - окислителю (ox1) соответствует восстановленная форма (red1), а восстановителю (red2)–окисленная форма (ox2), вместе они образуют сопряженную окислительно-восстановительную пару (полуреакцию):
Сложение обеих полуреакций позволяет записать в общем виде окислительно-восстановительную реакцию:
. Окислительно-восстановительные реакции делятся на два типа:
1). Межмолекулярные реакции – протекают с изменением степени окисления атомов в разных молекулах; обмен электронами в этих реакциях происходит между различными атомами или молекулами
2KMnO4 + 5K2SO3 + 3H2SO4 ® 2MnSO4 + 6K2SO4 + 3H2O.
Частный случай межмолекулярных реакции – реакции конпропорционирования, в которых окислитель и восстановитель – один и тот же элемент, но в разных степенях окисления:
3MnSO4 + 2KMnO4 + 2H2O ® 5MnO2 + 2KHSO4 + H2SO4.
2). Ввнутримолекулярные реакции – протекают с изменением степеней окисления атомов в одной и той же молекуле (внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель):
(NH4)2Cr2O7 ® N2 + Cr2O3 + 4H2O.
Здесь атомы хрома восстанавливаются (+6 ® +3), а азота - окисляются (-3 ® 0). Частный случай внутримолекулярных реакций – реакции диспропорционирования (самоокисления – самовосстановления) - окислительно-восстановительные реакции, в которой один элемент одновременно повышает и понижает степень окисления: 3Cl2 + KOH ® 5KCl + KСlO3 + 3H2O.
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления, могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов - (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями, и восстановителями, в зависимости от партнера, с которым взаимодействуют, и от условий реакции. Таблица 1 - Важнейшие восстановители и окислители
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.200.139 (0.007 с.) |


 Окисление - Восстановление -
Окисление - Восстановление -
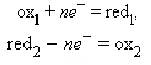 .
.



