Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительные процессыСодержание книги
Поиск на нашем сайте Окислительно-восстановительные процессы
Методические рекомендации по выполнению лабораторных работ по курсу "ХИМИЯ" для студентов специальностей 120100, 130400, 190900, 351100, 170600, 060800, 071900, 171200, 17150, 230100 всех форм обучения
Бийск 2004
УДК 546 (075.5) Макрушина Т.И. Верещагин А.Л. Окислительно-восстановитель-ные процессы: Методические рекомендации по выполнению лабораторных работ по курсу "ХИМИЯ".
Алт. гос. тех. ун-т БТИ. – Бийск. Изд-ство Алт. гос. тех. ун-та, 2004. – 57 с.
Настоящее методические рекомендации представляют собой основные сведения по окислительно-восстановительным процессам, содержат описание правил и методики проведения лабораторной работы по окислительно-восстановительным реакциям. Методические рекомендации предназначен для студентов специальностей 120100 – Технология машиностроения, 130400 – Ракетные двигатели, 190900 – Информационно–измерительная техника; 351100 – Товароведение и экспертиза товаров, 170600- Машины и аппараты пищевых производств, 071900 – Информационные системы и технологии, 171200 – Автоматизированное производство химических предприятий, 171500 – Высокоэнергетические устройства автоматических систем, 230100 – Эксплуатация и обслуживание транспортных технологических машин и оборудования всех форм обучения.
Рассмотрено и утверждено на заседании кафедры прото-кол № 11 от 15.01.2004 г
Рецензент: к.х.н., доцент кафедры ХТОСА Орлова З.В.
ã БТИ Алт. ГТУ, 2004
Введение Окислительно-восстановительные реакции играют важную роль в природе и технике. В качестве примеров окислительно-восстановительных процессов, протекающих в природных биологических системах, можно привести реакцию фотосинтеза у растений и процессы дыхания у животных и человека, реакции обмена веществ в живых организмах. Процессы сжигания топлива, протекающие в топках котлов тепловых электростанции и в двигателях внутреннего сгорания, являются примерами технически важных окислительно-восстановительных реакций. Окислительно-восстановительные реакции можно наблюдать в процессах коррозии металлов и при электролизе. Они лежат в основе металлургических процессов и кругооборота элементов в природе. С их помощью получают многие ценные продукты (аммиак, щелочи, азотную, соляную, серную кислоты и т. д.). Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую в гальванических элементах и аккумуляторах. Они же лежат в основе мероприятий по охране природы. Исследование космоса стало возможным вследствие использования реакций между такими сильными восстановителями, как водород, гидразин и керосин, и окислителями – кислородом и оксидами азота.
Теоретическая часть
Классификация химических реакций Все многообразие химических процессов можно разделить на два типа
1. Реакции, протекающие без изменения степени окисления элементов, входящих в состав реагирующих веществ. Например: а) Ca(OH)2 + 2CO2 = Ca(HCO3)2 реакция соединения; б) NaOH + HCl = NaСl+H2O реакция обмена; в) CaCO3 = CaO + CO2 реакция разложения. Сохранение степени окисления показывает, что электронные оболочки атомов в реакциях данного типа претерпевают незначительные изменения. Ни один из атомов или ионов не теряет и не приобретает электронов. Такие реакции называются электростатическими.
2. Реакции, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ:
а) все реакции замещения:
Zn0+H21+SO4 = Zn2+SO4+H20 ;
б) реакции соединения, в которых участвует хотя бы одно простое вещество: Fe0+S0 = Fe2+S2-, 2 FeCl2+Cl2 = 2 FeCl3;
в) реакции разложения, когда требуется хотя бы одно простое вещество: 2Ag+2O = 4Ag+O2
и многие другие реакции, например,
Mn4+O2+4HСl-1 = Mn2+Cl2+Cl20+2H2O.
Изменение степени окисления связано с потерей или приобретением электронов. Поэтому реакции данного типа называются электронно-динамическими. Современная классификация – по донорно-акцепторному механизму: а) электрон-донорно-акцепторные – это окислительно-восстанови-тельные реакции; б) протон-донорно-акцепторные – кислотно-основное взаимодействие по Бренстеду-Лоури; в) партикуло-донорно-акцепторные – реакции комлексообразования . Все химические реакции, в которых электроны переходят от одного вещества или его части к другому веществу или к другой части одного и того же вещества, называются окислительно-восстановительными, или red -ox (редокс) процессами.
потеря электронов, т. е. приобретение электронов, т. е. повышение степени окисления понижение степени окисления Окилитель Восстановитель присоединяет электроны, сам отдает электроны, сам окисляется, восстанавливается, понижает повышает своею степень окисления свою степень окисления
Любому веществу - окислителю (ox1) соответствует восстановленная форма (red1), а восстановителю (red2)–окисленная форма (ox2), вместе они образуют сопряженную окислительно-восстановительную пару (полуреакцию):
Сложение обеих полуреакций позволяет записать в общем виде окислительно-восстановительную реакцию:
. Окислительно-восстановительные реакции делятся на два типа:
1). Межмолекулярные реакции – протекают с изменением степени окисления атомов в разных молекулах; обмен электронами в этих реакциях происходит между различными атомами или молекулами
2KMnO4 + 5K2SO3 + 3H2SO4 ® 2MnSO4 + 6K2SO4 + 3H2O.
Частный случай межмолекулярных реакции – реакции конпропорционирования, в которых окислитель и восстановитель – один и тот же элемент, но в разных степенях окисления:
3MnSO4 + 2KMnO4 + 2H2O ® 5MnO2 + 2KHSO4 + H2SO4.
2). Ввнутримолекулярные реакции – протекают с изменением степеней окисления атомов в одной и той же молекуле (внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель):
(NH4)2Cr2O7 ® N2 + Cr2O3 + 4H2O.
Здесь атомы хрома восстанавливаются (+6 ® +3), а азота - окисляются (-3 ® 0). Частный случай внутримолекулярных реакций – реакции диспропорционирования (самоокисления – самовосстановления) - окислительно-восстановительные реакции, в которой один элемент одновременно повышает и понижает степень окисления: 3Cl2 + KOH ® 5KCl + KСlO3 + 3H2O.
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления, могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов - (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями, и восстановителями, в зависимости от партнера, с которым взаимодействуют, и от условий реакции. Таблица 1 - Важнейшие восстановители и окислители
И их соединений
Окислительно-восстановительные свойства элементов и их соединений связаны с положением элементов в Периодической системе элементов Д.И. Менделеева. Простые вещества – неметаллы обладают большими окислительными свойствами, а металлы – большими восстановительными свойствами. Наиболее энергетически устойчива восьмиэлектронная конфигурация (правило октета), и атомы в окислительно-восстановительных реакциях (ОВР) стремятся приобрести эту конфигурацию. Элементы, у которых число электронов на внешнем слое от 1 до 3 - отдают их, а от 5 до 7 – присоединяют электроны, дополняя свой внешний слой до октета. Превращение атомов в положительно заряженные ионы определяется величиной энергии ионизации наружных электронов. Энергия ионизации электрона первого снаружи слоя является периодической функцией зарядов атомов ядер. Чем меньше энергия ионизации элемента, тем ярче выражены его восстановительные свойства. Это наблюдается у элементов, в атомах которых внешний энергетический уровень содержит только s-электроны и одни p-электроны. Например,: K, Na, Mg, Ca. По мере увеличения числа электронов в p–подуровне наружного энергетического уровня, энергия ионизации резко возрастает. Превращение атомов в отрицательно заряженные ионы определяется величиной сродства к электрону. Чем больше сродство, тем ярче выражены окислительные свойства элемента. Сродство к электрону является периодической функцией зарядов атомных ядер. У первых элементов каждого периода сродство к электрону очень мало. Значительной величины оно достигло у кислорода и элементов главной подгруппы VII группы, у них на p–подуровне содержится от 4 до 5 электронов. Поэтому в каждом периоде по мере повышения порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные свойства повышаются. В каждой главной подгруппе с повышением порядкового номера увеличиваются восстановительные свойства простых веществ и уменьшаются окислительные.
Например, VI группа, главная подгруппа. Кислород «О» проявляет только окислительные свойства, фосфор – в основном, восстановительные. Элементы побочных подгрупп, атомы которых на внешнем энергетическом уровне содержат только s-электроны, проявляют только восстановительные свойства.
Восстановительных процессов Предсказать направление окислительно-восстановительных реакций дает возможность второй закон термодинамики. Условием протекания окислительно-восстановительной реакции в прямом направлении, как и любой другой является изменение энергии Гиббса DG<0. Например, возможно протекание реакции в прямом направлении:
Mg + H2O(ж) ® MgO + H2, DG= - 94,5 кдж/моль
и невозможно для реакции:
Pd + H2O(ж) ® PbO + H2, DG= 126,5 кдж/моль
Считать изменение энергии Гиббса DG для окислительно-восстановительных реакций дело трудоемкое. С другой стороны, DG, как известно, определяет работу химической реакции, в данном случае работу по переносу электронов. Процессы непосредственного превращения химической энергии в электрическую и обратно называются электрохимическими процессами. Их можно разделить на две группы: 1) процессы превращения химической энергии в электрическую (работа гальванических и топливных элементов, разрядка аккумулятора, выработка электричества животными); 2) процессы превращения электрической энергии в химическую (электролиз, электрическая коррозия, зарядка аккумулятора и др.). В окислительно-восстановительных реакциях происходит переход электронов от одних молекул, атомов или ионов к другим. При этом энергия у ряда химических реакций может превращаться в теплоту. Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником. Ионным проводником (проводником второго рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость (проводники 1-го рода) и находящиеся в контакте с ионным проводником. Рассмотрим металл в растворе его соли. Возможны два процесса – а) металл растворяется, переходит в раствор, образуя положительные ионы: Мтв ↔ М2+aq + 2e, при этом электроны останутся на пластине, заряжая ее отрицательно. На границе металл–раствор возникает двойной электрический слой. Между пластиной и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода. При некотором значении потенциала скорость прямого процесса будет равна скорости обратного процесса, и потенциал в таких условиях называется равновесным электродным; б) если в качестве металла взять медь, она будет забирать электроны с пластины и заряжать ее положительно: М2+aq+2e®Mтв. Возникает также разность потенциалов между электролитом и пластиной, которая зависит от природы металла и от концентрации ионов. Если две таких пластины соединить, пойдет ток, между пластинами возникает разность потенциалов. Работа такого гальванического элемента определяется разностью потенциалов:
где n – наименьшее общее кратное числа отдаваемых и принимаемых в реакции электронов; F=96487 кулонов - количество электричества, необходимое для растворения или восстановления одного химического эквивалента металла или другого вещества; Е - разность потенциалов полуреакций восстановления или электродвижущая сила (ЭДС) гальванического элемента, В; R=8,314,Дж/моль ∙ К -универсальная газовая постоянная; Т - температура по шкале Кельвина.
Уравнение Нернста
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих трех параметров: 1) от природы веществ-участников электродного процесса; 2) от концентраций (активностей) этих веществ (или ионов); 3) от температуры системы. И эта зависимость выражается уравнением Нернста (1.5). Критерий возможности самопроизвольного протекания электрохимической (окислительно-восстановительной) реакции – отрицательная величина
aA + bB ↔ cC + dD
В положении равновесия
Тогда
E = -
E =E0 - (RT/nF) ln([C]c[D]d/[A]a[B]b), (1.5)
где n- число электронов, принимающих участие в полуреакции; Kр = [C]cравн[D]dравн/[A]aравн[B]bравн - константа равновесия. Для обычной при электрохимических измерениях стандартной температуры (25 °С = 298 К) при подстановке значений постоянных величин (R=8,31 Дж/(моль ∙ К), F=96500 Кл/грамм-эквивалент) уравнение (1.5) принимает вид:
Е = Е°298 + 0,059 / z *lg(C Oic. / С восст.). (1.6)
Если в качестве электрода используют металл, погруженный в раствор его соли, то рассматриваемая формула примет вид:
Е = Е0298 + 0,059 / z * lg С ок, (1.7)
так как концентрация твердой фазы (металла) принимается равной 1. ЭДС гальванического элемента определяется как разность потенциалов восстановления электродов, причем от большего потенциала отнимают меньший:
ЭДС = Е1 (катода) - Е2 (анода). (1.8)
В уравнении Нернста, строго говоря, нужно вместо концентраций пользоваться активностями ионов. Если разность стандартных восстановительных потенциалов невелика (не более 0,3 В), направление окислительно-восстановительной реакции можно изменить, изменяя концентрации веществ и температуру. Гальванический элемент, составленный из двух одинаковой природы электродов, которые различаются только концентрацией одноименных ионов металла в растворах, называется концентрационным. Например, схема такого элемента, составленная из двух медных электродов, которые опущены в два раствора сульфата меди с различной молярной концентрацией имеет вид:
Сu CuSO4(10-6 М) | КСl | CuSO4(lM) | Сu.
ЭДС концентрационного элемента можно определить по формуле
ЭДС конц. гальв. эл. = 0,059 / z ∙ lg(Clок. / С2ок.). (1.9)
Электролиз
Электролиз - это окислительно-восстановительный процесс, который протекает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов. Сущность электролиза заключается в том, что при пропускании тока через раствор электролита (или расплавленный электролит) положительно заряженные ионы перемещаются к катоду, а отрицательно заряженные – к аноду. Достигнув электродов, ионы разряжаются, в результате чего у электродов выделяются составные части растворенного электролита или водород и кислород из воды. Для перевода различных ионов в нейтральные атомы или группы атомов требуется различное напряжение электрического тока. Одни ионы легче теряют свои заряды, другие труднее. Степень легкости, с которой разряжаются (присоединяют электроны) ионы металлов, определяется положением металлов в ряду напряжений. Чем левее стоит металл в ряду напряжений, чем больше его отрицательный потенциал (или меньше положительный потенциал), тем труднее при прочих равных условиях разряжаются его ионы (легче всего разряжаются ионы Аu3+, Ag+; труднее всего Li+, Rb+, K+). Если в растворе одновременно находятся ионы нескольких металлов, то в первую очередь разряжаются ионы того металла, у которого отрицательный потенциал меньше (или положительный – больше). Например, из раствора, содержащего ионы Zn2+ и Cu2+, на медной пластине выделяется металлическая медь. Но величина потенциала металла зависит также и от концентрации его ионов в растворе; точно также изменяется и легкость разряда ионов каждого металла в зависимости от их концентрации: увеличение концентрации облегчает разряд ионов, уменьшение – затрудняет. Поэтому при электролизе раствора, содержащего ионы нескольких металлов, может случиться, что выделение более активного металла будет происходить раньше, чем выделение менее активного (если концентрация ионов первого металла значительна, а второго – очень мала). В водных растворах солей, кроме ионов соли, всегда имеются еще и ионы воды (Н+ и ОН-). Из них ионы водорода будут разряжаться легче, чем ионы всех металлов, предшествующих водороду в ряду напряжений. Однако ввиду ничтожной концентрации водородных ионов при электролизе всех солей, кроме солей наиболее активных металлов, у катода происходит выделение металла, а не водорода. Только при электролизе солей натрия, кальция и других металлов до алюминия включительно разряжаются ионы водорода и выделяется водород. У анода могут разряжаться или ионы кислотных остатков, или гидроксильные ионы воды. Если ионы кислотных остатков не содержат кислорода (Cl-, S2-, CN- и др.), то обычно разряжаются именно эти ионы, а не гидроксильные, которые теряют свой заряд значительно труднее, и у анода выделяются Cl2, S и т.д. Наоборот, если электролизу подвергается соль кислородсодержащей кислоты или сама кислота, то разряжаются гидроксильные ионы, а не ионы кислородных остатков. Образующиеся при разряде гидроксильных ионов нейтральные группы ОН тотчас же разлагаются по уравнению:
4OH ® 2H2O + O2.
В результате у анода выделяется кислород.
Таблица 3 – Электролиз
В растворе или расплаве электролита происходит его диссоциация на ионы. При включении электрического тока ионы приобретают направленное движение и на поверхности электродов могут происходить окислительно-восстановительные процессы. На катоде возможно восстановление молекул воды и/или катионов металла. Если металл более активен, чем алюминий (и сам алюминий), то единственной реакцией на катоде будет восстановление воды. Если металл по активности находится между алюминием и водородом, то на катоде будут протекать обе конкурирующие реакции – и восстановление воды, и восстановление металла, в результате чего уменьшается выход реакции по току. Если металл расположен правее водорода, то должна протекать единственная реакция – восстановление катиона металла. В школьном курсе химии анализ чаще всего производят путём определения положение металла – левее алюминия и правее алюминия* - и составления уравнения только одной реакции (восстановления металла или воды). При анализе процессов, происходящих на аноде, в первую очередь обращают внимание на материал, из которого изготовлен анод. Если анод металлический (кроме платины и осмия), то происходит растворение анода по реакции (3).
* Строго говоря, выбор реакции на катоде определяется соотношением величины стандартного электродного потенциала металла и потенциалов разложения воды (-1,4 В) и перенапряжения выделения водорода (-0,41 В). При электролизе растворов соединений металлов, у которых Е<-1,4 В, происходит только разложение воды. В области -1,4 В<Е<-0,41 В конкурируют реакции разложения воды и восстановления металла. Для металлов с Е >-0,41 В происходит восстановление металла.
Если анод инертный (графитовый, платиновый, иногда - оксидный), то окисляются анионы бескислородной кислоты. Коррозия металлов Коррозия металлов - это разрушение их в результате химического, физико-химического и механического взаимодействия с внешней средой. Металл при этом переходит в окисленное состояние и теряет свою прочность и другие качества. Примерно около 15 % ежегодной добычи металла расходуется на возмещение потерь из-за коррозии металлических деталей и конструкций. Вред, приносимый коррозией, обусловлен не только потерей большого количества металла, но и порчей и выходом из строя самих металлических изделий, т.к. вследствие коррозии они теряют прочность, герметичность, пластичность, электро- и теплопроводимость и другие требуемые качества, причем коррозионная стойкость различных металлов неодинакова. Ущерб, причиняемый коррозией, определяется также громадными затратами на всевозможные защитные мероприятия, ухудшением состояния оборудования и качества продукции, возрастанием возможностей аварий и т.д. Все вышеуказанное объясняет необходимость детального и глубокого изучения коррозионных процессов и актуальность работ, связанных с повышением коррозионной стойкости металлов. Коррозия является окислительно-восстановительным процессом. При этом происходит переход катионов металла в окружающую среду: M – ne = M n+ и связывание освобождающихся электронов частицами окислителя, которые имеются в окружающей среде. Если процессы окисления металла и восстановления окислителя происходят одновременно и не разделены в пространстве, то говорят о химической коррозии металла. Такая коррозия происходит чаще всего в сухих газах, например, при разрушении стальных труб при производстве хлора: 2Fe + 3Cl = 2FeCl. Если процессы окисления металла и восстановления окислителя происходят не одновременно и разделены в пространстве цепью переноса освободившихся электронов, то говорят об электрохимической коррозии. Такая коррозия имеет место в растворах электролитов и влажном воздухе. Чаще всего в этих случаях окислителем являются катионы водорода Н+, всегда присутствующие в водном растворе 2Н+ + 2е = Н2, или молекулы кислорода в присутствии молекул воды по уравнению: О2 + 2Н2О + 4е = 4ОН-. Говорят, что в первом случае происходит коррозия с водородной деполяризацией, во втором – с кислородной деполяризацией. Слово «деполяризация» следует понимать так: окислитель, который отводит электроны от разрушающегося металла и снимает появившуюся поляризацию (избыточные заряды) с этого металла. Фактором, который изменяет, иногда катастрофически, скорость электрохимической коррозии, является контакт двух металлов различной активности. В этом случае более активный металл начинает разрушаться быстрее, а менее активный металл оказывается защищённым от коррозии (на нем происходит восстановление частиц окислителя-деполяризатора). В качестве мер защиты от коррозии или снижения её скорости применяют следующие: 1) изолирующие (защитные) покрытия: лаки, краски, плёнки, смазки и т.п. - эти покрытия уменьшают скорость коррозии как в результате затруднения выхода металла в окружающую среду, так и в результате затруднения доступа окислителя к поверхности металла; 2) создание препятствий выходу катионов металла (электрохимическая защита) - это достигают либо подключением защищаемого металла к отрицательному полюсу источника тока (катод, катодная защита), либо соединяя защищаемое металлическое изделие с более активным металлом («жертвенный анод»)*; 3) использование специальных (легированных) сплавов, состав которых подбирают таким образом, чтобы скорость коррозии в данной коррозионно-активной среде была наименьшей; 4) использование ингибиторов коррозии, которые уменьшают скорость разрушения металла; ингибиторы коррозии могут как добавлять в агрессивную среду, например, при перевозке кислот по железной дороге или транспортировке газа по газопроводам, так и вводить в состав защитного покрытия (ингибированные смазки и др.); 5) снижение агрессивности среды путем ее обработки; например, использование деаэрации воды (удаление растворенного в воде кислорода) является обязательным приемом снижения коррозионных потерь на всех промышленных предприятиях. 6) рациональное конструирование и эксплуатацию металлических сооружений и деталей, которые предполагают исключение неблагоприятных металлических контактов или применение изоляции, устранение щелей и зазоров в конструкции, устранение зон застоя влаги, ударного действия струй, резких изменений скоростей потоков в конструкциях и т.д. Наибольший эффект в борьбе с коррозией достигается при использовании наиболее действенных или нескольких методов защиты.
Электрохимическая коррозия
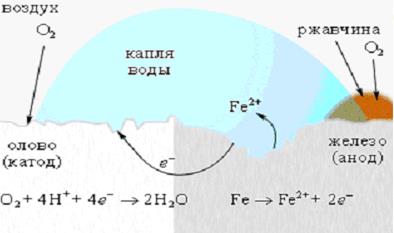
Рассмотрим коррозию железа как электрохимический процесс. Ржавление железа есть не что иное, как анодная реакция
* Часто применяют так называемую анодную защиту, при этом потенциал корродирующего металла специальными способами сдвигают в область пассивации.
Катодная реакция – восстановление атмосферного кислорода:
Водородные ионы поставляет вода. Если бы в воде не было растворенного кислорода, то коррозия была бы невозможна. Следовательно, железо корродирует в слое воды, насыщенном кислородом. Таким образом, начальную стадию коррозии железа можно передать реакцией
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение концентрации ионов водорода pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9…10 коррозия железа практически прекращается. Известно, что в водной среде ионы Fe2+ в присутствии кислорода окисляются до Fe3+. Вторая стадия коррозии соответствует реакции образования гидратированного оксида железа (ржавчины) Fe2O3∙nH2O:
Для защиты железа от коррозии используются всевозможные покрытия: краска, слой металла (олова, цинка). При этом краска и олово предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности железа, и процесс коррозии возобновляется, причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (рисунок 4).
Оцинкованное железо ведет себя иначе. Поскольку цинк выполняет роль анода, то его защитная функция сохраняется и при нарушении цинкового покрытия (рисунок 6).
Катодная защита широко используется для уменьшения коррозии подземных и подводных трубопроводов и стальных опор высоковольтных передач, нефтяных платформ и причалов.
Экспериментальная часть Цель работы 1) исследовать окислительные свойства соединений в высших, низших и промежуточных степенях окисления; 2) изучить влияние величины рН на состав продуктов окислительно-восстановительной реакции.
Опыт 1. Вытеснение металлов из солей другими металлами Железную проволоку или железный гвоздь опустить в пробирку с раствором сульфата меди на 1…2 минуты. Вынуть. Сполоснуть водой. Обратить внимание на происходящее явление и написать уравнение реакции. Внимание: после опыта слейте растворы в емкость «для слива»! Вопросы и задания: 1) опишите наблюдаемое явление. 2) напишите уравнения химических реакции и расставьте коэффициенты методом электронного баланса; 3) рассчитайте стандартные значения DЕ0э, DG, Кр реакции; 4) сделайте выводы.
Опыт 2. Окисление азотной кислотой В пробирку положить несколько кусочков медной стружки и прилить разбавленную азотную кислоту. Вопросы и задания: 1) опишите наблюдаемое явление; 2) напишите уравнения химических реакций и расставьте коэффициенты методом электронного баланса; 3) рассчитайте стандартные значения DЕ0э, DG0 и Кр; 4) сделайте выводы. Опыт3. Окислительные свойства MnO4- в различных средах а). Проведите реакцию между сульфатом железа (соль Мора), перманганатом калия в кислой среде – добавьте серной кислоты. Что наблюдаете?
FeSO4 + KMnO4 +H2S O4 ® K2S O4 + Fe2(S O4)3 + MnSO4 +H2O
б). проведите реакцию между сульфатом железа, перманганатом калия в щелочной среде. В чем разница между этими реакциями? В какой среде Mn7+ проявляет большие окислительные свойства?
FeSO4 + KMnO4 +KOH ® K2SO4 + Fe(OH)3 + К2MnO4 Вопросы и задания: 1) опишите наблюдаемое явление; 2) напишите уравнение химической реакции и расставьте коэффициенты методом электронного баланса; 3) как влияет среда на состав продуктов реакции? 4) рассчитайте стандартные значения DЕ0э, DG0 и Кр.
Опыт 4. Окислительно-восстановительные свойства хрома в высших и низших степенях окисления а). Восстановление Cr6+ ® Cr3+ К раствору KIприлейте разбавленную серную кислоту и раствор бихромата калия.
KJ + H2SO4 + K2Cr2O7 ® Cr2 (SO4)3 + K2SO4 + J2 + H2O
б). Окисление Cr3+ ® Cr6+ К раствору сульфата хрома прилейте раствор щёлочи KOH до растворения осадка, затем добавьте раствор перманганата калия. Нагрейте.
Cr2 (SO4)3 +KOH + KMO4 ® K2SO4+K2CrO4+ MnO2+ H2O Вопросы и задания: 1) опишите наблюдаемое явление; 2) напишите уравнение химических реакций и расставьте коэффициенты методом электронного баланса; 3) приведите три примера веществ, проявляющих как свойства окислителя, так и восстановителя; 4) рассчитайте стандартные значения DЕ0э, DG0 и Кр. 5) сделайте выводы.
Техника безопасности При работе в лаборатории студент должен иметь халат. Рабочее место не дол
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 281; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.170 (0.023 с.) |


 Окисление - Восстановление -
Окисление - Восстановление -
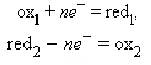 .
.
 G = -z ∙ F ∙ Е, (1.1)
G = -z ∙ F ∙ Е, (1.1) G реакции. В общем случае для реакции
G реакции. В общем случае для реакции


 -
-