
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Омогенные и гетерогенные реакцииСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда — вещества, окружающие систему. Обычно система отграничена от среды.Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы. Гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства системы изменяются скачком.Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом. Другим примером гомогенной системы может служить раствор хлорида натрия, сульфата магния, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фазы: из газовой фазы в первом примере и из водного раствора во втором.Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается вовсемобъемераствора:H2SO4+Na2S2O3= Na2SO4+Н2O+SO2+SЕсли реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте:Fe+2HCl=FeCl2 + H2может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества. В связи с этим4скорость гомогенной реакции и скорость гетерогенной реакции определяются различно,Скорость гомогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы. В 1867 г. К. М. Гульберг и П. Вааге открыли так называемый закон действия масс, устанавливающий зависимость скорости химической реакции от концентрации. Согласно этому закону скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. 16. каталитический процесс - это совокупность обычных химических реакций (в растворе, на поверхности или в газе), но совокупность особенная, имеющая циклический характер Циклическую природу каталитического процесса можно наглядно представить в виде графа, у которого в вершинах (кружках) будут находиться промежуточные вещества и катализатор, а линии, связывающие вершины (ребра), будут соответствовать стадиям механизма. Тогда схема (2) будет представлена простым циклическим графом Влияние различных факторов на каталитическую реакцию (особенности электронного строения твердого тела и его поверхности, геометрия поверхности, особенности электронного строения комплексов металлов, свойства растворителей и др.) не отличается от влияния тех же факторов на любую химическую реакцию. 17. ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:в системах с газовой фазой — уравнением изохоры Вант-ГоффаВ небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:Например, в реакции синтеза аммиакаN2 + 3H2 ⇄ 2NH3 + Qтепловой эффект в стандартных условиях составляет +92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта. Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3 Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C: Влияние концентрации на состояние равновесия подчиняется следующим правилам:При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. 18. По степени раздробленности (дисперсности) системы делятся на следующие классы: грубодисперсные, размер частиц в которых более 10-5 м; тонкодисперсные (микрогетерогенные) с размером частиц от 10-5 до 10-7 м; коллоидно-дисперсные (ультрамикро-гетерогенные) с частицами размером от 10-7 до 10-9м. Если фиксировать внимание на двух основных компонентах дисперсных систем, то одному из них следует приписать роль дисперсионной среды, а другому - роль дисперсной фазы. В этом случае все дисперсные системы можно классифицировать по агрегатным состояниям фаз.Эта классификация была предложена Оствальдом и широко используется до настоящего времени. Недостатком классификации следует считать невозможность отнесения дисперсных систем, приготовленных с твердой или жидкой дисперсной фазой, к какому-либо классу, если размер частиц составляет несколько нанометров. Пример такой классификации приведен в табл. 1.Академик П.А. Ребиндер предложил более совершенную классификацию дисперсных систем по агрегатным состояниям фаз. Он разделил все дисперсные системы на два класса: свободнодисперсные системы и сплошные (или связнодисперсные) системы (табл. 2 и 3). В свободнодисперсных системах дисперсная фаза не образует сплошных жестких структур (сеток, ферм или каркасов). Эти системы называют золями. В сплошных (связнодисперсных) системах частицы дисперсной фазы образуют жесткие пространственные структуры (сетки, каркасы, фермы). Такие системы оказывают сопротивление деформации сдвига. Их называют гелями.Дисперсная система по классификации Ребиндера обозначается дробью, в которой дисперсная фаза ставится в числителе, а дисперсионная среда – в знаменателе. Например: Т1/Ж2. Индекс 1 обозначает дисперсную фазу, а индекс 2 – дисперсионную среду Коллоидная химия изучает свойства как тонко-, так и грубодисперсных систем; как свободно-, так и связнодисперсных систем.Включение в одну науку столь большого количества разнообразных систем, различных как по природе фаз, так и по размерам частиц и агрегатному состоянию фаз, основано на том, что все они обладают общими свойствами - гетерогенностью и принципиальной термодинамической неустойчивостью. Центральное место в коллоидной химии занимают ультрамикрогетерогенные системы со свободными частицами. Это - так называемые, коллоидные системы. Гомогенная система – система, состоящая из одной фазы.Гетерогенная система – система, состоящая из двух или большего числа фаз. Фаза – часть системы, однородная по составу и строению и отделенная от других частей системы (других фаз) границей раздела (межфазной границей). 19. физ.-хим. системы, содержащие не менее трех компонентов. Компонентами системы наз. в-ва, изменения масс к-рых независимы и выражают все возможные изменения в составе системы. Если в системе отсутствуют обратимые хим. р-ции, число компонентов равно числу в-в, содержащихся в системе. В случае систем с хим. превращениями число компонентов равно разности между числом сортов частиц, содержащихся в системе, и числом независимых р-ций. Это объясняется тем, что условия хим. равновесия выражаются как количеств. связи между концентрациями в-в, а число таких связей равно числу независимых хим. р-ций. СОЛЬВАТЫ, продукты присоединения р-рителя к растворенным в-вам. Частный случай сольватов-гидраты (р-ритель-вода). Обычно сольваты образуются в р-ре, но нередко (при охлаждении р-ра, испарении р-рителя и др.) м. б. получены в виде кристаллич. фаз-кристаллосольватов. Напр., из р-ра LiCl в метаноле и в жидком NH3 кристаллизуются соотв. LiCl·4CH3OH и LiCl·5NH3. Гидраты — продукты присоединения воды к неорганическим и органическим веществам. 20. Концентрацию веществ в растворах можно выразить разными способами. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.1. Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:w(B)= m(B) / m Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах.2. Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.C(B) = n(B) / V = m(B) / (M(B) · V), где М(B) - молярная масса растворенного вещества г/моль.Молярная концентрация измеряется в моль/л и обозначается "M".Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.C(B) = n(B) / V = m(B) / (M(B) · V), где М(B) - молярная масса растворенного вещества г/моль.Молярная концентрация измеряется в моль/л и обозначается "M". 3. Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода. 21. О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя). Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества. Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться. Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию. Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки (тургорное давление). Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос. За счёт этого повышается упругость растения в целом. 22. Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в растворителе или при плавлении.ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ, полный или частичный распад молекул растворенного в-ва на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Электролитическая диссоциация, как правило, происходит в полярных р-рителях. При электролитической диссоциации разрываются обычно лишь наиб. полярные связи молекул, Электролитической диссоциацией могут подвергаться молекулы нек-рых р-рителей, напр. воды.Электролитическая диссоциация лежит в основе деления р-ров на два класса - растворы неэлектролитов и растворы электролитов. Наблюдаемое различие в коллигативных св-вах разбавленных р-ров электролитов и неэлектролитов объясняется тем, что из-за электролитической диссоциации увеличивается общее число частиц в р-ре. Это, в частности, приводит к увеличению осмотич. давления р-ра сравнительно с р-рами неэлектролитов, понижению давления пара р-рителя над р-ром, увеличению изменения т-ры кипения и замерзания р-ра относительно чистого р-рителя. Электролитическая диссоциация объясняется также ионная электропроводность электролитов. электролитическая диссоциация бинарного электролита KA выражается уравнением типа: Константа диссоциации Значение где
Вода - растворитель Энергия образования молекул воды высока, она составляет 242 кДж/моль. Этим объясняется устойчивость воды в природных условиях. Устойчивость в сочетании с электрическими характеристиками и молекулярным строением делают воду практически универсальным растворителем для многих веществ. Высокая диэлектрическая проницаемость обусловливает самую большую растворяющую способность воды по отношению к веществам, молекулы которых полярны. Из неорганических веществ в воде растворимы очень многие соли, кислоты и основания* Из органических веществ растворимы лишь те, в молекулах которых полярные группы составляют значительную часть — многие спирты, амины, органические кислоты, сахара и т.д. Растворение веществ в воде сопровождается образованием слабых связей между их молекулами или ионами и молекулами воды. Это явление называется гидратацией. Для веществ с ионной структурой характерно формирование гид ратных оболочек вокруг катионов за счет донорно-акцепторной связи с неподеленной парой электронов атома кислорода. Катионы гидратированы тем в большей степени, чем меньше их радиус и выше заряд. Анионы, обычно менее гидратированные, чем катионы, присоединяют молекулы воды водородными связями. В процессе растворения веществ изменяется величина электрического момента диполя молекул воды, изменяется их пространственная ориентация, разрываются одни и образуются другие водородные связи. В совокупности эти явления приводят к перестройке внутренней структуры. Растворимость твердых веществ в воде зависит от природы этих веществ и температуры и изменяется в широких пределах. Повышение температуры в большинстве случаев увеличивает растворимость солей. Однако растворимость таких соединений, как CaSO4·2H2O, Ca(OH)2 при повышении температуры снижается. При взаимном растворении жидкостей, одной из которых является вода, возможны различные случаи. Например, спирт и вода смешиваются друг с другом в любых соотношениях, так как оба полярны. Бензин (неполярная жидкость) в воде практически нерастворим. Наиболее общим является случай ограниченной взаимной растворимости. Примером могут служить системы вода—эфир, вода—фенол. При нагревании взаимная растворимость для одних жидкостей возрастает, для других — уменьшается. Например, для системы вода—фенол повышение температуры выше 68°С приводит к неограниченной взаимной растворимости. Газы (например, NH3, СО2, SO2) хорошо растворимы в воде, как правило, в тех случаях, когда они вступают с водой в химическое взаимодействие; обычно же растворимость газов невелика. При повышении температуры растворимость газов в воде уменьшается. Ниже приведены данные по растворимости в воде (при атмосферном давлении) кислорода важнейшего элемента для всех биологических процессов в водоемах и сооружениях по очистке загрязненных вод. Температура воды, °С 0 10 20 30 Концентрация О2, мг/л 14,62 11,33 9,17 7,63 Следует отметить, что растворимость кислорода в воде почти в 2 раза выше, чем растворимость азота. Вследствие этого состав растворенного в воде водоемов или очистных сооружений воздуха отличается от атмосферного. Растворенный воздух обогащен кислородом, что очень важно для организмов, обитающих в водной среде. Для водных растворов, как и для любых других, характерны понижение упругости пара над раствором (по сравнению с чистым растворителем), понижение температуры замерзания и повышение температуры кипения. Одно из общих свойств растворов проявляется в явлении осмоса. Если два раствора разной концентрации разделены полупроницаемой перегородкой, молекулы растворителя проникают через нее из разбавленного раствора в концентрированный. Механизм осмоса можно понять, если учесть, что, согласно общему естественному принципу, все молекулярные системы стремятся к состоянию наиболее равномерного распределения (в случае двух растворов — стремление к выравниванию концентраций по обе стороны перегородки). Количественной характеристикой осмоса служит осмотическое давление. По закону Вант-Гоффа осмотическое давление раствора равно давлению, которое проявляло бы растворенное вещество, если бы оно было газообразным и занимало бы объем, равный объему раствора.
24. ИО́ННЫЕ РЕА́КЦИИ (от греч. «ion» — идущий), химические реакции между ионами Протекают в растворах электролитовс большой скоростью. Их механизм объясняется с точки зрения теории электролитической диссоциации. Различают обратимые и необратимые ионные реакции. Условиями необратимости являются образование осадка или малодиссоциирующих веществ, а также выделение газа. Ионные реакции записываются как в полной, так и в сокращенной форме: Mg2+ + 2Cl- + 2Na+ + 2OH- ® Mg(OH)2 + 2Na+ + 2Cl- (полное) Mg2+ + 2OH- ® Mg(OH)2 (сокращенное).Одинаковые ионы сокращаются и получается сокращенное ионное уравнение.В растворах слабых электролитов между недиссоциированных молекул и их ионами устанавл ивается равновесие при определенных условиях (концентрация, температура). Изменение условий приводит смещение равновесия. Так, введение в раствор одноименных ионов смещает ионное равновесие 25. Водоро́дный показа́тель, pH мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: Вывод значения pH В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10−14 моль²/л² (при 25 °C).Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−] говорят, что раствор является кислым, а при [OH−] > [H+] — щелочным.Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH. 26. Твёрдые растворы — фазы переменного состава, в которых атомы различных элементов расположены в общей кристаллической решётке.Могут быть неупорядоченными (с хаотическим расположением атомов), частично или полностью упорядоченными. Экспериментально упорядоченность определяют, главным образом, рентгеновским структурным анализом.Способность образовывать твёрдые растворы свойственна всем кристаллическим твёрдым телам. В большинстве случаев она ограничена узкими пределами концентраций, но известны системы с непрерывным рядом твёрдых растворов (например, Cu—Au, Ti—Zr, GaAs—GaP). По существу, все кристаллические вещества, считающиеся чистыми, представляют собой твёрдые растворы с очень малым содержанием примесей.Различают три вида твёрдых растворов:твёрдые растворы замещения;твёрдые растворы внедрения;твёрдые растворы вычитания.непрерывный ряд твёрдых растворов замещения в металлических системах образуются лишь теми элементами, которые, во-первых, имеют близкие по размерам атомные радиусы (отличающиеся не более чем на 15 %) и, во-вторых, находятся не слишком далеко друг от друга в электрохимическом ряду напряжений. При этом элементы должны иметь один и тот же тип кристаллической решётки. В твёрдых растворах на основе полупроводников и диэлектриков, благодаря более «рыхлым» кристаллическим решёткам образование твёрдых растворов замещения возможно и при большем различии атомных радиусов.Если атомы компонентов существенно различаются по размерам или электронной структуре, возможно внедрение атомов одного элемента в междоузлия решётки, образованной другим элементом. Подобные твёрдые растворы часто образуются при растворении неметаллов (B, H2, O2, N2, C) в металлах.Твёрдые растворы вычитания, возникающие за счёт появления в кристаллической решётке вакантных узлов, образуются при растворении одного из компонентов в химическом соединении и характерны для нестехиометрических соединений.Образование твёрдых растворов при легировании элементов и соединений имеет большое значение в производстве сплавов, полупроводников, керамики, ферритов.Твёрдые растворы — основа всех важнейших конструкционных и нержавеющих сталей, бронз, латуней, алюминиевых и магниевых сплавов высокой прочности. Свойства твёрдых растворов регулируют их составом, термической или термомеханической обработкой. Легированные полупроводники и многие сегнетоэлектрики, являющиеся основой современной твердотельной электроники, также являются твёрдыми растворами.При распаде твёрдых растворов сплавы приобретают новые свойства. Наиболее ценными качествами обладают сплавы с очень тонкой неоднородностью — так называемые дисперсионно-твердеющие, или стареющие твёрдые растворы. Дисперсионное твердение может наблюдаться и при распаде твёрдых растворов на основе соединений, например, нестехиометрических шпинелей. 27. Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).Различают обратимый и необратимый гидролиз солей[1]:Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону): (раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)Гидролиз соли слабой кислоты и слабого основания:(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.Степень гидролизаПод степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);α = (cгидр/cобщ)·100 % где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.Является количественной характеристикой гидролиза.Факторы, влияющие на степень гидролиза.Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.Концентрация продуктов гидролиза. В соответствии с принципом Ле Шателье, повышение концентрации ионов водорода приведет к смещению равновесия влево. Степень гидролиза будет уменьшаться.Концентрация соли- равновесие в системе смещается вправо, но степень гидролиза уменьшается.Разбавление. при разбавлении равновесие смещается в сторону протекания этой реакции, вправо, степень гидролиза возрастает.Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. 28. Для всех обсуждаемых теорий характерно, что в них определения кислоты и оснований зависят от определения понятия кислотно-основного процесса, в котором реагирующие между собой Кислоты и основания являются таковыми лишь по отношению друг к другу. Единой теории кислотно-основного взаимодействия и, следовательно, понятий кислоты и основания пока нет. В настоящее время наиболее широко используются две теории кислоты и оснований: электронная и протонная. Кислоты и основания в современной электронной теории классифицируют по типу орбиталей, принимающих участие в образовании межмолекулярных донорно-акцепторных связей в кислотно-основном комплексе. При таком подходе все кислоты (акцепторы) разделяют на s-, v- и p-типы, все основания (доноры) - на п-, s- и p-типы.Любое основание может вступать во взаимодействии с любой кислотой. Одно и то же соединение в зависимости от партнера может выступить как основание или как кислота.Протонная теория Брёнстеда-ЛауриВ ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии: А В + Н+ (А - кислота, В - основание). Согласно этой теории кислотами являются молекулы или ионы, способные быть в данной реакции донорами протонов, а основаниями являются молекулы или ионы, присоединяющие протоны (акцепторы). Кислоты и основания получили общее название протолитов.Сущностью кислотно-основного взаимодействия является передача протона от кислоты к основанию. При этом кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание, образуя протонированную частицу, становится кислотой. Таким образом, в любом кислотно-основном взаимодействии участвуют две пары кислот и оснований, названные Бренстедом сопряженными: А1 + В2 А2 + В1.Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность). Например, вода при взаимодействии с сильными кислотами является основанием: H2O + H+ H3О+, а реагируя с аммиаком, становится кислотой: NH3 + H2O NH4+ + OH−.Электронная теория ЛьюисаВ теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары. Это, например, ионы водорода – протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот. Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода, спирты, галогены. Примеры химических реакций между кислотами и основаниями Льюиса:AlCl3 + Cl− → AlCl4−BF3 + F− → BF4−PCl5 + Cl− → PCl6−. 29. Комплексные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.Комплексные соединения мало диссоциируют в растворе Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+), либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы.Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам, хлорофилл находящийся в растениях является комплексом.Комплексные соединения находят широкое применение в различных отраслях промышленности. Химические методы извлечения металлов из руд связаны с образованием КС. Например, для отделения золота от породы руду обрабатывают раствором цианида натрия в присутствии кислорода. 30. Классификация комплексных соединений. Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия «комплексная частица» нет. Обычно используется следующее определение.1. Аквакомплексы в качестве лигандов содержат молекулы воды - H2O. Образуются они при взаимодействии безводных веществ с водой (в частности, при растворении в воде), например:CuSO4(т) + 4H2O = [Cu(H2O)4]SO4(р) CuSO4 + 4H2O = [Cu(H2O)4]2+ + SO42-2. Гидроксокомплексы в качестве лигандов содержат гидроксид-ионы - OH-. Образуются при взаимодействии металлов, оксиды и гидроксиды которых амфотерны, а также указанных оксидов и гидроксидов с избытком раствора щелочи, например:Zn(т) + 2H2O(р) = Zn(OH)2(т) + H2(г) - 1 стадия Zn(OH)2(т) + 2NaOH(р) = Na2[Zn(OH)4] (р) - 2 стадия Сложив два уравнения, получим итоговое уравнение реакции: Zn(т) + 2H2O(р) + 2NaOH(р) = Na2[Zn(OH)4] (р) + H2(г) Zn + 2H2O + 2OH- = [Zn(OH)4]2+ + H2 Кроме того, гидроксокомплексы получают обменной реакцией взаимодействия солей металлов, гидроксиды которых амфотерны, с избытком раствора щелочи, например: 3. Амминокомплексы (аммиакаты, аммины) в качестве лигандов содержат молекулы аммиака - NH3. Образуются амминокомплексы как в водном растворе гидрата аммиака (при его избытке):так и при действии на вещества (или при пропускании через раствор вещества) газообразного или жидкого аммиака, например: Mg(ClO4)2(т) + 6NH3(г) = [Mg(NH3)6](ClO4)2(р) Mg(ClO4)2 + 6NH3 = [Mg(NH3)6]2+ + 2ClO4 4. Ацидокомплексы в качестве лигандов содержат анионы (кислотные остатки), их получают взаимодействием, чаще всего, двух солей: а также взаимодействием металлов, оксидов с солями, кислотами, смесями кислот (царская водка и др.):5. Карбонилкомплексы (карбонилы) в качестве лигандов содержат молекулы монооксида углерода - CO. Карбонилкомплексы получают взаимодействием d- металлов в порошкообразном состоянии с газообразным CO при повышенном давлении и обычных температурах или небольшом (200-300 °С) нагревании, 31. Диссоциация комплексных соединений. Разрушение комплексных соединений.Диссоциация комплексных соединений.В растворах КС имеет место первичная и вторичная диссоциация (в расплавах КС происходит их термическая диссоциация). Первичная диссоциация протекает по типу сильных электролитов - практически необратимо: Первичной диссоциации не подвергаются комплексы без внешней сферы: [Pt(NH3)2Cl2], [Co(NH3)3(NO3)3].Вторичная диссоциация характеризует диссоциацию самого комплекса. Она протекает в незначительной степени, подчиняется закону действия масс. Этот процесс характеризуют константой диссоциации. Так как величина этой конс
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 550; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.28.200 (0.013 с.) |


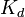 определяется активностями катионов
определяется активностями катионов  , анионов
, анионов  и недиссоциированных молекул
и недиссоциированных молекул  следующим образом:
следующим образом: 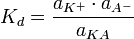

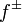 — средний коэффициент активности электролита.
— средний коэффициент активности электролита.



