
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость скорости реакции от концентрации реагентовСодержание книги Поиск на нашем сайте
Зависимость скорости реакции от концентрации реагентов Чтобы произошла химическая реакция необходимо столкновение молекул реагирующих веществ. Число таких столкновений растет с увеличением числа молекул в единице объема, т. е. с возрастанием концентрации реагентов. Соответственно, с повышением концентрации реагирующих веществ увеличивается скорость реакции. Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс, который был открыт опытным путем в 1867 г. К. Гульдбергом и П. Вааге (Норвегия). Скорость химической реакции, протекающей при постоянной температуре в гомогенной среде, прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов, называемых порядками реакции по реагентам. Рассмотрим гомогенный процесс окисления оксида азота (II):2NO(Г) + O2(Г) = 2NO2(Г). Обозначим концентрации реагирующих веществ:
Константа скорости реакции зависит от химической природы реагирующих веществ, температуры процесса, наличия в системе катализатора, но не зависит от концентрации реагирующих веществ. В случае гетерогенных реакций в математическое выражение закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрации веществ, находящихся в твердой фазе, представляют собой постоянную величину и входят в константу скорости реакции.
Смещение химического равновесия. Принцип Ле-Шателье. Гетерогенное химическое равновесие подчиняется принципу Ле-Шателье. Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказывать внешнее воздействие (t,p,c), то равновесие смещается в сторону той реакции, которая ослабляет произведенное воздействие. При повышении температуры равновесие смещается в сторону эндотермической реакции. При повышении давления или концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции. При повышении общего давления равновесие смещается в направлении уменьшения числа молекул газообразных веществ. Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.
Окислительно-восстановительные свойства нейтральных атомов: металлы, неметаллы, инертные элементы (Энергия ионизации, сродство к электрону, электроотрицательность). Изменение свойств атомов по периодам и группам ПСЭ. Энергия, необходимая для удаления одного моля электронов от одного моля атомов какого либо элемента, называется первой энергией ионизации I1, кДж/моль или эВ. Её величина характеризует восстановительную способность элемента и возрастает по периоду ПСЭ. Наименьшее значение I1 имеют щелочные металлы, находящиеся в начале периодов. Атомам неметаллов недостает до завершения внешних электронных оболочек (аналогично инертным элементам) от 1 до 4 электронов, конфигурация их внешних энергетических уровней: ns2npN, где N от 5 до 2 (IV – VII(A) группы). Образуя соединения с другими элементами, атомы неметаллов R способны принимать электроны (восстанавливаться) на внешние уровни, переходя в отрицательно заряженные ионы с устойчивой конфигурацией атомов инертных элементов: R + ne →Rn-, таким образом, неметаллы проявляют свойства окислителей. Энергия, выделяющаяся при присоединении моля электронов к молю нейтральных атомов называется сродством к электрону Еср, кДж/моль или эВ. Сродство к электрону зависит от положения элемента в ПСЭ, возрастает по периодам и имеет max значение для атомов галогенов. Для сравнительной оценки окислительно-восстановительных свойств атомов введено понятие электроотрицательность (ЭО) – это количественное выражение способности атома притягивать электрон при образовании соединений с другими атомами. ЭО измеряется по шкале Л. Полинга (США) в относительных литиевых единицах (ЭОLi = 1), (см. табл. 5 приложения). Следовательно, главным химическим свойством атомов элементов является их окислительная или восстановительная способность, которая определяется положением элемента в ПСЭ. В пределах периода с ростом заряда ядра атома увеличивается количество электронов на внешнем энергетическом уровне, но количество уровней остается неизменным, радиус атома уменьшается, так как электронная оболочка сильнее стягивается к ядру. Чем меньше электронов на внешнем энергетическом уровне и чем больше радиус атома, тем легче электроны отрываются от атома, т. е. сильнее выражены его восстановительные (металлические) свойства. Чем больше электронов на внешнем энергетическом уровне и меньше радиус атома, тем сильнее выражены окислительные (неметаллические) свойства элемента. Следовательно, в периодах от начала к концу ослабляется восстановительная активность атомов и возрастает окислительная, т. е. наблюдается переход от атомов с типичными свойствами металлов к атомам с типичными свойствами неметаллов, электроотрицательность атомов при этом возрастает. В пределах группы элементов (главной подгруппы) с ростом заряда ядра атомов увеличивается количество энергетических уровней атомов, т. е. растет радиус атомов, количество же электронов на внешнем уровне остается неизменным, однако, они все далее отстают от ядра атома и такие электроны легче оторвать от атома. Таким образом, восстановительная активность атомов по группам сверху вниз возрастает, а окислительная – снижается, уменьшается и величина ЭО атомов. Самые сильные окислители (неметаллы) находятся в правом верхнем углу ПСЭ: F, Cl, O. Самые сильные восстановители (металлы) находятся в левом нижнем углу: Fr, Ba, Ra.
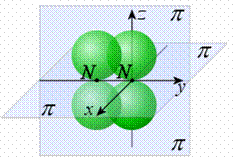
Образование химической связи по методу молекулярных орбиталей (ММО). 1. Молекулярная орбиталь (МО) является аналогам атомной орбитали (АО): подобно тому, как электроны в атомах располагаются на АО, общие электроны в молекуле располагаются на МО. 2. Для образования МО атомные орбитали должны обладать приблизительно одинаковой энергией и симметрией относительно направления взаимодействия. 3. Число МО равно общему числу АО, из которых комбинируются МО. 4. Если энергия МО оказывается ниже энергии исходных АО, то такие МО – связывающие, а если выше энергии исходных АО, то – разрыхляющие МО (рис. 11). 5. Электроны заполняют МО, как и АО в порядке возрастания энергии, при этом соблюдается принцип Паули и правило Гунда. 6. МО двухатомных молекул первого периода и второго (до N2) располагают в ряд: σ1s < σ* 1s < σ2s < σ* 2s < π2рy = π2рz < σ2px < π*2рy = =π*2рz < σ*2px. МО двухатомных молекул конца второго периода по возрастанию энергии располагают: σ1s < σ* 1s < σ2s < σ* 2s<σ2px < π2рy = π2рz < π*2рy =π*2рz < σ*2px 7. В методе МО вместо кратности связи вводится понятие порядок связи n – полуразность числа связывающих и числа разрыхляющих электронов: Порядок связи может быть равен нулю, целому или дробному положительному числу. При n = 0 молекула не образуется 8. Если на МО имеются неспаренные электроны, молекула парамагнитна, т. е. обладает магнитными свойствами; если все электроны спарены – диамагнитна,т. е. не обладает магнитными свойствами ММО по сравнению с МВС позволяет получить реальные представления о химической связи и свойствах различных частиц (молекулы, ионы). Электронные конфигурации молекул Виды ковалентной связи. Ионная связь. Примеры и свойства веществ. Ковалентная связь существует двух видов: полярная и неполярная. -Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например, в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора. - Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью. Ионная (электровалентная) связь – это сильнополярная ковалентная связь. В ее основе лежит электростатическое взаимодействие ионов. Согласно ей, атомы элементов с числом электронов в наружном слое меньше восьми присоединяют или теряют такое число электронов, которое делает наружный электронный слой таким, как у атома ближайшего инертного газа. Атом, потерявший электроны, превращается в положительно заряженный ион (катион). Атом, присоединивший электроны, становится отрицательно заряженным ионом (анион). Разноименно заряженные ионы притягиваются друг к другу. Возникновение ионной связи имеет место только в том случае, если элементы, атомы которых реагируют между собой, обладают резко отличными значениями энергии ионизации и сродства к электрону. Ионных соединений немного. Они обладают основными свойствами: в расплавленном состоянии обладают электропроводностью, в воде легко диссоциируют на ионы (растворяются), имеют высокую температуру плавления и кипения. Ионная связь характеризуется следующими показателями: Ненаправленность. Ионы – заряженные шары, их силовые поля равномерно распределяются во всех направлениях в пространстве, поэтому они притягивают противоположный по знаку ион в любом направлении. Ненасыщаемость. Взаимодействие двух ионов не может привести к полной взаимной компенсации их силового поля. Поэтому у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Ионный кристалл ( ПРИМЕРЫ: Неполярная ковалентная O2, N2, Cl2 Полярная ковалентная HCl, H2O, NH3 Ионная NaI, MgBr2, AlC3l, CaCl2 21)Направленность ковалентной связи (σ и π-связи), гибридизация атомных электронных орбиталей, формы молекул. Направленность – т. е. связь образуется в направлении максимального перекрытия электронных облаков. Относительно линии соединяющей центры атомов образующих связь различают: σ и π (рис. 9):
Схема образования связей в молекуле N2: 1)σ-связей, 2)π-связей
Гибридизация – это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Химическая связь, образуемая с участием электронов гибридных орбиталей, более прочная, чем связь с участием электронов негибридных s- и р-орбиталей, так как происходит большее перекрывание. Различают следующие виды гибридизации: sp-гибридизация – одна s-орбиталь и одна p-орбиталь превращаются в
две одинаковые «гибридные» орбитали, угол между осями которыхравен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию (BeCl2). sp2-гибридизация – одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp2-гибридизация, имеют плоскую геометрию (BF3, AlCl3). sp3 - гибридизация – одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраэдрическую геометрию (CH4, NH3). Зависимость скорости реакции от концентрации реагентов Чтобы произошла химическая реакция необходимо столкновение молекул реагирующих веществ. Число таких столкновений растет с увеличением числа молекул в единице объема, т. е. с возрастанием концентрации реагентов. Соответственно, с повышением концентрации реагирующих веществ увеличивается скорость реакции. Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс, который был открыт опытным путем в 1867 г. К. Гульдбергом и П. Вааге (Норвегия). Скорость химической реакции, протекающей при постоянной температуре в гомогенной среде, прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов, называемых порядками реакции по реагентам. Рассмотрим гомогенный процесс окисления оксида азота (II):2NO(Г) + O2(Г) = 2NO2(Г). Обозначим концентрации реагирующих веществ:
Константа скорости реакции зависит от химической природы реагирующих веществ, температуры процесса, наличия в системе катализатора, но не зависит от концентрации реагирующих веществ. В случае гетерогенных реакций в математическое выражение закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрации веществ, находящихся в твердой фазе, представляют собой постоянную величину и входят в константу скорости реакции.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 303; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.60.19 (0.007 с.) |

 . Математическое выражение закона действия масс для процесса примет вид:
. Математическое выражение закона действия масс для процесса примет вид: (кинетическое уравнение химической реакции) где К – константа скорости реакции.
(кинетическое уравнение химической реакции) где К – константа скорости реакции.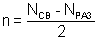 .
.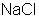 ) – гигантская молекула из ионов. Из отдельных молекул ионные соединения состоят только в парообразном состоянии.
) – гигантская молекула из ионов. Из отдельных молекул ионные соединения состоят только в парообразном состоянии.
 180°
линейная
180°
линейная
 1200
плоская тригональная
1200
плоская тригональная
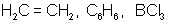
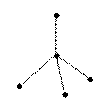 109°28
тетраэдрическая
109°28
тетраэдрическая

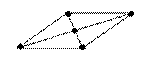 90°
квадратная
90°
квадратная
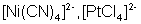
 90°, 120°
триагонально-бипирамидальная
90°, 120°
триагонально-бипирамидальная

 90°
октаэдрическая
90°
октаэдрическая




