
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы химических связей и типы молекул.Содержание книги Поиск на нашем сайте
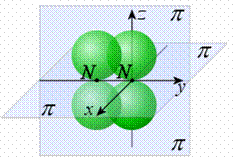
Химическая связь – это совокупность сил, действующих между атомами или группой атомов. Химическая связь осуществляется валентными электронами. По современным представлениям химическая связь имеет электронную природу, но осуществляется она по-разному. Поэтому различают три основных типа химической связи: ковалентную, ионную, металлическую. Ковалентная связь. Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной. Ионная (электровалентная) связь – это сильнополярная ковалентная связь. В ее основе лежит электростатическое взаимодействие ионов. Согласно ей, атомы элементов с числом электронов в наружном слое меньше восьми присоединяют или теряют такое число электронов, которое делает наружный электронный слой таким, как у атома ближайшего инертного газа. Металлическая связь основана на обобществлении валентных электронов, принадлежащих не двум, а практически всем атомам металла в кристалле. В металлах валентных электронов намного меньше, чем свободных орбиталей. Это создает условия для свободного перемещения электронов по орбиталям разных атомов металла. Внутри металла происходит непрерывное хаотичное движение электронов от атома к атому, т. е. электроны становятся общими. При создании разности потенциалов происходит согласованное движение электронов – это объясняет электрическую проводимость данных веществ. В металлах небольшое число электронов одновременно связывает множество атомных ядер – эта особенность называется делокализацией. Водородная связь – одна из разновидностей взаимодействия между полярными молекулами, образуется между электроотрицательными атомами одной молекулы и атомами водорода другой, типа Н-Х (Х – это F, O, N, Cl, Br, I) за счет сил электростатического притяжения. Существует четыре типа молекул: ароматические, непредельные, нафтеновые и парафиновые. Виды ковалентной связи. Ионная связь. Примеры и свойства веществ. Ковалентная связь существует двух видов: полярная и неполярная. -Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например, в молекуле PH3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора. - Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью. Ионная (электровалентная) связь – это сильнополярная ковалентная связь. В ее основе лежит электростатическое взаимодействие ионов. Согласно ей, атомы элементов с числом электронов в наружном слое меньше восьми присоединяют или теряют такое число электронов, которое делает наружный электронный слой таким, как у атома ближайшего инертного газа. Атом, потерявший электроны, превращается в положительно заряженный ион (катион). Атом, присоединивший электроны, становится отрицательно заряженным ионом (анион). Разноименно заряженные ионы притягиваются друг к другу. Возникновение ионной связи имеет место только в том случае, если элементы, атомы которых реагируют между собой, обладают резко отличными значениями энергии ионизации и сродства к электрону. Ионных соединений немного. Они обладают основными свойствами: в расплавленном состоянии обладают электропроводностью, в воде легко диссоциируют на ионы (растворяются), имеют высокую температуру плавления и кипения. Ионная связь характеризуется следующими показателями: Ненаправленность. Ионы – заряженные шары, их силовые поля равномерно распределяются во всех направлениях в пространстве, поэтому они притягивают противоположный по знаку ион в любом направлении. Ненасыщаемость. Взаимодействие двух ионов не может привести к полной взаимной компенсации их силового поля. Поэтому у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Ионный кристалл ( ПРИМЕРЫ: Неполярная ковалентная O2, N2, Cl2 Полярная ковалентная HCl, H2O, NH3 Ионная NaI, MgBr2, AlC3l, CaCl2 21)Направленность ковалентной связи (σ и π-связи), гибридизация атомных электронных орбиталей, формы молекул. Направленность – т. е. связь образуется в направлении максимального перекрытия электронных облаков. Относительно линии соединяющей центры атомов образующих связь различают: σ и π (рис. 9):
Схема образования связей в молекуле N2: 1)σ-связей, 2)π-связей
Гибридизация – это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Химическая связь, образуемая с участием электронов гибридных орбиталей, более прочная, чем связь с участием электронов негибридных s- и р-орбиталей, так как происходит большее перекрывание. Различают следующие виды гибридизации: sp-гибридизация – одна s-орбиталь и одна p-орбиталь превращаются в
две одинаковые «гибридные» орбитали, угол между осями которыхравен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию (BeCl2). sp2-гибридизация – одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp2-гибридизация, имеют плоскую геометрию (BF3, AlCl3). sp3 - гибридизация – одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 340; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.131.13.196 (0.007 с.) |

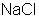 ) – гигантская молекула из ионов. Из отдельных молекул ионные соединения состоят только в парообразном состоянии.
) – гигантская молекула из ионов. Из отдельных молекул ионные соединения состоят только в парообразном состоянии.
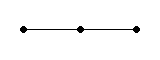 180°
линейная
180°
линейная
 1200
плоская тригональная
1200
плоская тригональная
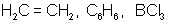
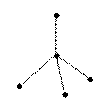 109°28
тетраэдрическая
109°28
тетраэдрическая

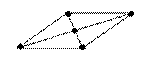 90°
квадратная
90°
квадратная
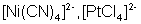
 90°, 120°
триагонально-бипирамидальная
90°, 120°
триагонально-бипирамидальная

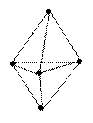
 90°
октаэдрическая
90°
октаэдрическая




