
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетика химических реакций. I закон термодинамики.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химической системой называют группу веществ, находящихся в ограниченном объёме, всё, что окружает эту систему, составляет внешнюю среду. Химические системы бывают открытыми (обмен с внешней средой веществом и энергией), закрытыми (обмен с внешней средой только энергией) и изолированными (никакого обмена с внешней средой). При протекании многих химических реакций изменяется энергетическое состояние химической системы. Реакции горения, нейтрализации, взаимодействия металлов с кислотами сопровождаются выделением тепла; процесс растворения солей в воде чаще всего идёт с поглощением тепла; при работе аккумуляторов и гальванических элементов выделяется электрическая энергия; реакции фотосинтеза, люминесценции, фотоэффекта сопровождаются световыми эффектами; при взрывах химические процессы идут с выделением механической энергии. Возможность самопроизвольного перехода химической системы из одного состояния в другое и энергетические эффекты этих процессов изучает химическая термодинамика. Соотношение между потребляемой и выделяющейся энергиями в ходе реакции (Епотребляемая <,=,>Евыделяемая) определяет величину и знак энергетического эффекта процесса, вид же энергии зависит от химической природы и агрегатного состояния исходных веществ и продуктов реакции. Раздел химии – термохимия изучает тепловые эффекты химических реакций. Тепловым эффектом Q [кДж/моль, кДж] называется выделение или поглощение тепловой энергии системой при протекании в ней химической реакции, при условии, что система не совершает никакой другой работы кроме работы расширения. Химические процессы бывают: – экзотермические (идут с выделением тепла) +Q; – эндотермические (идут с поглощением тепла) – Q. При постоянстве параметров внешней среды процессы бывают: V= Const (изохорические) ±; P= Const (изобарические) ±; T= Const (изотермические) Q= 0; P= Const,P= Const (изобарно-изотермические) P = 0. Уравнения процессов, в которых указаны тепловые эффекты, называются термохимическими, в них также отмечается агрегатное состояние веществ и допускаются дробные стехиометрические коэффициенты: 2H2 + O2 = 2H2O – обычная запись уравнения реакции; Н2(Г) + 1/2О2(Г) = Н2О(Г) + 241,6 кДж/моль; Н2(Г) + 1/2О2(Г) = Н2О(Ж) + 285,8 кДж/моль. Величина и знак теплового эффекта Q процесса зависит от химической природы исходных веществ и продуктов реакции, их агрегатного состояния и начальной температуры процесса. Понятия о внутренней энергии и энтальпии химической системы, энтальпия фазовых переходов Термодинамические свойства химической системы можно выразить с помощью нескольких функций состояния: – внутренняя энергия U; – энтальпия H; – энтропия S; – энергия Гиббса или изобарно-изотермический потенциал G. Значения функций зависят от состава и внутреннего строения вещества, а также внешних условий: давления, температуры, концентрации и пр. Внутренняя энергия системы U – это её суммарная энергия, включающая энергию взаимодействия и движения молекул, атомов, ядер, электронов в атомах, внутриядерную и другие виды энергии, кроме кинетической Ek и потенциальной En энергии системы, как целого: . Абсолютную величину внутренней энергии замерить невозможно, однако, можно определить её изменение () при переходе системы из начального в конечное состояние: . Рассмотрим пример. 1 моль Zn реагирует с 1 молем H2SO4 в изохорных условиях (= Const), процесс – экзотермический, о прохождении реакции судим по выделяющемуся теплу. Обозначим внутреннюю энергию исходных веществ, продуктов реакции –. Zn(Т) + H2SO4(Ж) = ZnSO4(Ж) + H2(Г)↑ + > Тепло передаётся системой в окружающую среду за счёт уменьшения внутренней энергии исходных веществ, следовательно: < 0; (18)
В химических реакциях, протекающих при постоянном объёме (= Const), изменение внутренней энергии системы равно изохорному тепловому эффекту реакции, взятому с противоположным знаком. Таким образом, изменение внутренней энергии системы можно измерить с помощью теплоты Q. Теплота – это количественная мера хаотичного движения частиц данной системы, при этом не происходит переноса вещества от одной системы к другой.
Работа A – количественная мера направленного движения частиц в системе, мера энергии, передаваемой от одной системы к другой за счет перемещения вещества от одной системы к другой. Следовательно, Qp можно выразить: Воспользовавшись формулой 19, получим:
Обозначим: где H – энтальпия системы. Энтальпия H – это энергия расширенной системы (термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении). Так как В химических реакциях, протекающих при постоянном давлении Для экзотермических процессов ( Количественные соотношения между внутренней энергией системы, теплотой и работой устанавливает первый закон термодинамики: энергия не может ни создаваться, ни исчезать, она может только переходить из одного вида в другой: Энтальпией фазовых переходов называется разница между тепловыми эффектами или Н2О(Ж) Н2О(К) Н2О(К) Все рассмотренные процессы являются эндотермическими. Стандартной энтальпией образования сложного вещества ( Пример: Ca(К) + 1/2О2(Г) = СаО(К) + 635 кДж, следовательно, Величины сложных веществ занесены в таблицы термодинамических констант (см. приложение, табл. 6). Энтальпии образования простых веществ равны нулю (= 0). Как видно из этой таблицы, большинство сложных веществ образуется в экзотермических условиях. В 1841 г. российский учёный Г.И. Гесс открыл закон, который лежит в основе термохимических расчётов: «Тепловой эффект (изменение энтальпии) реакции зависит от химической природы и агрегатного состояния исходных веществ и продуктов реакции, но не зависит от пути её протекания, т. е. от числа и характера промежуточных стадий» (закон действует для изобарно-изотермических и изохорно-изотермических процессов): (28) II закон термодинамики Процессы, протекающие без подвода энергии от внешнего источника, называются самопроизвольными. Самопроизвольно протекает большинство экзотермических реакций (): реакции горения, образования ржавчины на металле, взаимодействия активных металлов с растворами кислот и водой и пр. Но существуют самопроизвольные и эндотермические процессы, например, растворение некоторых солей в воде. Следовательно, кроме энтальпийного фактора () имеется другая движущая сила самопроизвольных процессов. Рассмотрим пример. Имеется изолированный от окружающей среды сосуд с перегородкой, которая разделила его на две равные части. В одной половине сосуда инертный газ – аргон (Ar), в другой – инертный газ (He) (рис. 34). Концентрации газов, давление и температура одинаковы.
Рис. 34. Самопроизвольный переход системы к большему беспорядку Удалим перегородку в сосуде, энергетическое состояние системы не изменится, однако газы перемешаются, т. е. система самопроизвольно перейдёт из состояния 1 в состояние 2. Степень беспорядка в состоянии 1 < Степень беспорядка в состоянии 2; Вероятность существования сост. 1 (W1) < Вероятность существования сост. 2 (W2). Под термодинамической вероятностью существования системы W понимается, каким числом микросостояний системы можно описать данное макросостояние. При температуре абсолютного нуля (–273 °С) макросостояние системы описывается только одним микросостоянием, так как движение частиц при абсолютном нуле отсутствует. С повышением температуры число микросостояний системы увеличивается, так как усиливается движение микрочастиц. Следовательно, в изолированной системе самопроизвольно протекают процессы в направлении большего беспорядка или наиболее вероятного существования. Энтропией системы называется логарифм термодинамической вероятности существования системы: (29) где S –энтропия системы, Дж/моль·К; R–молярная Const, Дж/моль·К, W – термодинамическая вероятность системы. Энтропия S – количественная мера беспорядка в системе, чем выше энтропия, тем больше беспорядок, поэтому. Энтропия вещества в стандартных условиях называется стандартной энтропией, [Дж/моль∙ К]. В отличие от других термодинамических функций можно определить не только изменение энтропии, но и её абсолютное значение. Энтропия простого вещества не равна нулю (см. приложение, табл. 6). Изменение энтропии при самопроизвольном переходе системы из состояния 1 в состояние 2 (см. рис. 34) рассчитывается: . (30) Так как, то, а В изолированной системе самопроизвольно протекают процессы в направлении увеличения энтропии системы () (второй законтермодинамики, определяет принципиальную возможность и направление протекания процесса). Изменение энтропии химической реакции равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов. (31)
Контрольные вопросы 1. Определить знаки ΔН, ΔS, ΔG для реакции АВ (к.) + В2 (г.) = АВ3 (к.) протекающей при температуре 298 К в прямом направлении. Как будет изменяться значение ΔG с ростом температуры? 2. Исходя из теплоты образования газообразного диоксида углерода (ΔН° = —393,5 кДж/моль) и термохимического уравненияС (графит) + 2N20 (г.) = С02 (г.) + 2N2(г) вычислить теплоту образования N2O(г.). 3. При некоторой температуре Т эндотермическая реакция А→В практически идет до конца; Определить: а) знак Δ Sреакции; б) знак ΔG реакции В→А при температуре Т в) возможность протекания реакции В→А при низких температурах. 4. Могут ли в стандартных условиях реакции CI, (г.) + 2HI (г.) = 12 (к.) = 12 (к.) + 2HCI (г.) (1) 12 (к.) + H2S(г.) = 2HI(г.) + S(к.) (2) самопроизвольно протекать в прямом направлении при 298 К? Как скажется повышение температуры на направлении протекания этих реакции? 5. Пользуясь справочными данными, установить, возможно ли при температурах 298 и 2500 К восстановление диоксида титана до свободного металла по схеме: ТiO2 (к.) + 2С (графит) = Ti(к.) + 2СО (г.) Зависимостью ΔН0 и ΔS° от температуры пренебречь. 6. При соединении 2,1 г железа с серой выделилось 3,77 кДж. Рассчитать теплоту образования сульфида железа. 7. Найти количество теплоты, выделяющейся при взрыве 8,4 л гремучего газа, взятого при нормальных условиях.
Лекция № 6. Химическая кинетика Цель: Изучить понятие скорость химической реакции и методы ее регулирования. План: 1. Химическая кинетика(скорость хим реакции з-н действ масс) 2. Скорость реакции и методы ее регулирования. Закон действующих масс (влияние темп, природы реаг в-в на скорость химреакц) 3. Катализаторы и каталитические системы(катализ гомогенные и гетерогенные катализаторы, ферментативный катализ)
1. Химическая кинетика называют науку которая изучает факторы влияющие на скорость хим реакции и механизм хим реакции. 1. Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций). 1. Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени. Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом: (II.1) В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени: (II.2)
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 617; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.188.152 (0.011 с.) |


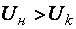 ,
,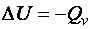 . (19)
. (19) .
. или
или 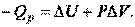 (23)
(23) (24)
(24) (25)
(25) (26)
(26) )
) 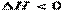 ; для эндотермических процессов (– Qp)
; для эндотермических процессов (– Qp) 
 │
│ 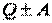 │;
│;  │. (27)
│. (27)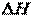 получения одного и того же вещества в различных агрегатных состояниях:
получения одного и того же вещества в различных агрегатных состояниях: Н2О(Г),
Н2О(Г),  .= + 44,2 кДж/моль;
.= + 44,2 кДж/моль; Н2О(Ж),
Н2О(Ж), 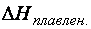 . = + 6,0 кДж/моль;
. = + 6,0 кДж/моль; Н2О(Г),
Н2О(Г), 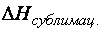 = + 50,25 кДж/моль.
= + 50,25 кДж/моль. ) называется тепловой эффект реакции образования 1 моля этого вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при стандартных условиях (T= 298 К и давлении 101 кПа).
) называется тепловой эффект реакции образования 1 моля этого вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при стандартных условиях (T= 298 К и давлении 101 кПа). = – 635 кДж/моль, = – 635 кДж/моль.
= – 635 кДж/моль, = – 635 кДж/моль.


