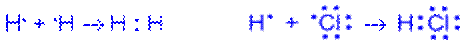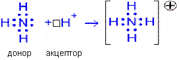Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические методы, применяемые при изучении строения молекул и химической связи. Основные положения методов валентных связей.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель: изучить теоретические методы, применяемые при изучении строения молекул и химической связи. Основные положения методов валентных связей. План. 1. Образование химической связи. 2. Ковалентная связь. Метод ВС. 3. Донорно-акцепторный механизм, образование ковалентной связи. 4. Ионная связь. 5. Водородная связь.
1. Существует 2 способа образования ковалентной связи: а. Каждый атом для образования связи использует свой неспаренный электрон Cl· + Cl· = Cl: Cl – это обменный способ. в. Один атом для образования химической связи использует электронную пару, у другой вакантную орбиталь NH3+H+=NH4+ - это донорно-акцепторный способ (механизм) Расстояние между ядрами атомов называют длиной связи или межъядерным расстоянием. Чем размеры атомов больше, тем больше и межъядерное расстояние Энергия химической связи – это минимальная энергия необходимая для разрыва химической связи. Энергия химической связи возрастает с увеличением кратности химической связи. Кратность связи численно равна числу электронных пар участвующих в образовании химической связи. Энергия химической связи увеличивается с уменьшением межъядерного расстояния. Ионная связь образуется в результате контакта двух атомов металла и неметалла. Электрон от атома металла переходит на вакантные орбитали атома неметалла. Атом металла заряжается положительно, а атом неметалла – отрицательно. Противоположно заряженные ионы удерживаются силами электростатического взаимодействия. Химическая связь – это совокупность сил, действующих между атомами или группой атомов. Химическая связь осуществляется валентными электронами. По современным представлениям химическая связь имеет электронную природу, но осуществляется она по-разному. Поэтому различают три основных типа химической связи: ковалентную, ионную, металлическую. Между молекулами возникает водородная связь, и происходят вандерваальсовые взаимодействия. К основным характеристикам химической связи относятся: ● длина связи – это межъядерное расстояние между химически связанными атомами. Она зависит от природы взаимодействующих атомов и от кратности связи. С увеличением кратности длина связи уменьшается, а, следовательно, увеличивается ее прочность;
● кратность связи – определяется числом электронных пар, связывающих два атома. С увеличением кратности энергия связи возрастает; ● угол связи – угол между воображаемыми прямыми проходящими через ядра двух химически взаимосвязанных соседних атомов; ● энергия связи ЕСВ – это энергия, которая выделяется при образовании данной связи и затрачивается на ее разрыв, кДж/моль. Ковалентная связь Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной. Объяснение химической связи возникновением общих электронных пар между атомами легло в основу спиновой теории валентности, инструментом которой является метод валентных связей (МВС), открытый Льюисом в 1916 г. Для квантово-механического описания химической связи и строения молекул применяют ещё один метод – метод молекулярных орбиталей (ММО). ● Метод валентных связей Основные принципы образования химической связи по МВС: 1. Химическая связь образуется за счет валентных (неспаренных) электронов. 2. Электроны с антипараллельными спинами, принадлежащие двум различным атомам, становятся общими. 3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается. 4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение. 5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Существует два механизма образования ковалентной связи Обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
а б Рис. Обменный механизм образования ковалентной связи: а неполярной; б – полярной
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь. Соединения, образованные по донорно-акцепторному механизму, относятся к комплексным соединениям
Рис. 8. Донорно-акцепторный механизм образования ковалентной связи Ковалентная связь имеет определенные характеристики.
Насыщаемость – свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав. Направленность – т. е. связь образуется в направлении максимального перекрытия электронных облаков. Относительно линии соединяющей центры атомов образующих связь различают: σ и π (рис. 9): σ -связь – образована перекрыванием АО по линии соединяющей центры взаимодействующих атомов; π -связь – это связь, возникающая в направлении оси перпендикулярной прямой, соединяющей ядра атома. Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму. Полярность – если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной, если электронная плотность смещена в сторону электроотрицательного атома, то ковалентная связь называется полярной. Полярность связи тем больше, чем больше разность электроотрицательностей атомов, молекула называется диполем. Диполь – это система, в которой имеется два электрических заряда, равных по величине, но противоположных по знаку, расположенных на некотором расстоянии друг от друга. Произведение длины диполя l, т. е. расстояния между полюсами в молекуле и величины заряда электрона ē называется дипольным моментом μ. Дипольный момент молекулы служит количественной мерой ее полярности. Дипольные моменты молекул измеряют в дебаях (D). Чем больше длина диполя (дипольный момент), тем больше полярность молекулы (и др.). Дипольный момент направлен от положительного конца диполя к отрицательному. Поэтому дипольный момент многоатомной молекулы следует рассматривать как векторную сумму дипольных моментов связей: он зависит не только от полярности каждой связи, но и от взаимного расположения этих связей. Поляризуемость – способность молекулы становиться полярной. Данное явление происходит под действием внешнего электрического поля или под влиянием другой молекулы, являющейся партнером по реакции. Существует обратная зависимость между полярностью и поляризуемостью ковалентной связи: чем больше полярность связи, тем меньше остается возможности для их дальнейшего смещения под действием внешних сил. Ионная связь Ионная (электровалентная) связь – это сильнополярная ковалентная связь. В ее основе лежит электростатическое взаимодействие ионов. Согласно ей, атомы элементов с числом электронов в наружном слое меньше восьми присоединяют или теряют такое число электронов, которое делает наружный электронный слой таким, как у атома ближайшего инертного газа. Атом, потерявший электроны, превращается в положительно заряженный ион (катион). Атом, присоединивший электроны, становится отрицательно заряженным ионом (анион). Разноименно заряженные ионы притягиваются друг к другу. Возникновение ионной связи имеет место только в том случае, если элементы, атомы которых реагируют между собой, обладают резко отличными значениями энергии ионизации и сродства к электрону. Ионных соединений немного. Они обладают основными свойствами: в расплавленном состоянии обладают электропроводностью, в воде легко диссоциируют на ионы (растворяются), имеют высокую температуру плавления и кипения. Ионная связь характеризуется следующими показателями:
Ненаправленность. Ионы – заряженные шары, их силовые поля равномерно распределяются во всех направлениях в пространстве, поэтому они притягивают противоположный по знаку ион в любом направлении. Ненасыщаемость. Взаимодействие двух ионов не может привести к полной взаимной компенсации их силового поля. Поэтому у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Ионный кристалл () – гигантская молекула из ионов. Из отдельных молекул ионные соединения состоят только в парообразном состоянии. Водородная связь Водородная связь – одна из разновидностей взаимодействия между полярными молекулами, образуется между электроотрицательными атомами одной молекулы и атомами водорода другой, типа Н-Х (Х – это F, O, N, Cl, Br, I) за счет сил электростатического притяжения. Связь между водородом и одним из этих атомов характеризуется достаточной полярностью, поскольку связующее электронное облако смещено в сторону более электроотрицательного атома. Водород в данном случае расположен на положительном конце диполя. Два и более таких диполя взаимодействуют между собой так, что ядро атома водорода одной молекулы (положительный конец диполя) притягивается неподеленной электронной парой второй молекулы. Данная связь проявляется в газах, жидкостях и твердых телах. Она относительно прочна. Наличие водородной связи обусловливает повышение устойчивости молекул вещества, а также повышению их температуры кипения и плавления. Образование водородных связей играет важную роль как в химических, так и в биологических системах. Водородная связь бывает внутри- и межмолекулярной молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей. Существование веществ в различных агрегатных состояниях свидетельствует о том, что между частицами (атомы, ионы, молекулы) имеет место взаимодействие, обусловленное ван-дер-ваальсовыми силами притяжения. Наиболее важной и отличительной чертой этих сил является их универсальность, так как они действуют без исключения между всеми атомами и молекулами. Межмолекулярные силы (вандерваальсовые силы) – взаимодействие между молекулами, в результате которого вещество переходит в жидкое или твердое состояние. Межмолекулярные силы имеют электрическую природу. Они обусловлены полярностью и поляризуемостью молекул. Различают три типа межмолекулярного взаимодействия: дипольное, индукционное, дисперсионное.
В молекулах, образованных более чем двумя атомами различных элементов, могут существовать разные типы связей.
Контрольные вопросы 1. Объяснить с позиций метода МО возможность существования молекулярного иона Не и невозможность существования молекулы Не2. 2. Какая из молекул — В2или С2 характеризуется более высокой энергией диссоциации на атомы? Сопоставить магнитные свойства этих молекул. 3. Чему равнаковалентность углерода в молекуле СО: а) двум; б) трем; в) четырем? 4. Может ли произойти реакция между HFи SiFа) может; б) не может? 5. Какими магнитными свойствами обладает молекула 02: а) диамагнитна; б) парамагнитна?, 6. Какова кратность связи в молекуле N0: а) два; б) два с половиной; в) три? 7. Какие из перечисленных частиц парамагнитны: a) N2; б) 02; в) N0; г) СО; д) CN? 8. Какие из перечисленных частиц не могут существовать в устойчивом состоянии с позиций теории МО: б) Н2; в) Н2; г) Не2; д) ННе?
Лекция № 5.
|
||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 569; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.37.122 (0.011 с.) |