
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая связь и строение молекул.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВ Введение
Центральной проблемой химии является установление природы химической связи в молекулах. Впервые теория химического строения молекул А.М. Бутлерова была дана в 1861 году. Положениями этой теории являются: свойства веществ зависят не только от их состава, но и от химического строения и характера взаимного влияния атомов в молекулах. Изучение природы взаимодействия атомов позволяет установить механизм образования и строения молекул и других частиц, что дает возможность предсказать реакционную способность, определить условия синтеза веществ с заданными свойствами. Проблема установления химической связи получила дальнейшее развитие в работах Льюиса, Гейтлера, Лондона, Морковникова, Семенова, Полинга, Гунда и других. По характеру распределения электронной плотности в молекулах химические связи традиционно подразделяются на ковалентные, ионные и металлические. Для ковалентно-механического описания ковалентной связи и строения молекул применяются два подхода: - метод валентных связей (МВС) и - метод молекулярных орбиталей (ММО). В основе МВС лежат следующие положения: - ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами; - ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака взаимодействующих атомов. Метод ВС прост, нагляден и позволяет предсказать свойства многих молекул, таких как пространственная конфигурация, полярность, энергия, длина связи и др. Но метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул: парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F+2 и O+2 по сравнению с молекулами F2 и O2; мéньшую прочность связи в ионе N+2 , чем в молекуле N2; существование молекулярного иона Не+2 и неустойчивость молекулы Не2 и т.д. Более плодотворным оказался другой подход к объяснению ковалентной связи – метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствующую образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомных орбиталей соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называются соответственно связывающими (св) и разрыхляющими (разр). Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Гунда. Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляют формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d – орбиталями молекулярные орбитали обозначаются греческим буквами σ, π, δ, φ. По возрастанию энергии МО орбитали двухатомных молекул первого периода и начала второго периода (до N2) можно расположить в следующем порядке:
σ св 1s < σразр 1s < σсв 2s < σразр 2s < πcв 2py = πcв 2pz < σсв2px < πразр 2py = πразр 2pz < σразр 2px Молекулярные орбитали двухатомных молекул конца второго периода по возрастанию энергии располагаются в несколько иной ряд:
σ св 1s < σразр 1s < σсв 2s < σразр 2s < σ св 2px <πcв 2py = πcв 2pz < πразр2py = πразр 2pz < σразр 2px Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю, когда молекула не существует, целому или дробному положительному числу.
Примеры решения задач Пример 1. Объясните механизм образования молекулы SiF6 и иона [SiF6]2-
Решение. Приводим электронную формулу атома кремния: 14Si-1s2 2s2 2p6 3s2 3p2 Приводим графическую схему распределения электронов по энергетическим ячейкам в: а) невозбужденном состоянии 3s 3p 3d
б) при возбуждении 14Si* - …
Четыре неспаренных электрона возбужденного атома кремния могут участвовать в образовании четырех ковалентных связей с атомами фтора (9F – 1s2 2s2 2p5), имеющему по одному неспаренному электрону с образованием молекулы. Для образования иона [SiF6]4- к молекуле SiF4 присоединяются два иона F- (1s2 2s2 2p6), все валентные электроны которых спарены. Связь осуществляется по донорно-акцепторному механизму за счет пары электронов каждого из фторид-ионов и двух валентных 3d-орбиталей атома кремния. Пример 2. Представьте электронную конфигурацию молекулы О2 по методу МО. Решение. Представим электронную конфигурацию молекулы О2 по методу МО: Электронная формула атома кислорода: 8O – 1s22s22p2x2p1y2p1z. Размещение электронов по молекулярным орбиталям: 2O (1s22s22px22p1y2p1z) = = O2{(σ св 1s)2(σразр 1s)2(σсв 2s)2(σразр 2s)2 (σ св 2px)2(πcв 2py)2(πcв 2pz)2(πразр2py)1(πразр 2pz)1} Определим порядок связи: Псв.= 10 – 6 / 2 = 4/2 = 2 В молекуле кислорода две кратные ковалентные химические связи: O = O Парамагнетизм молекулы кислорода объясняется тем, что на разрыхляющих π - молекулярных орбиталях содержится по одному неспаренному электрону. Контрольные задания 61. Что называется кратностью связи? Приведите примеры соединений, содержащих ординарные, двойные и тройные связи. Отметьте s- и p-связи в структурных формулах приведенных молекул.
62. Охарактеризуйте типы кристаллических структур по природе частиц узлов решеток. Какие кристаллические структуры имеют: CO2, CH3COOH, алмаз, графит, NaCl, Zn? Расположите их по порядку возрастания энергий кристаллических решеток. Что такое интеркалирование?
63. Почему существует молекула PCl5, но не существует молекула NCl5, хотя азот и фосфор находятся в одной и той же подгруппе VA периодической системы? Какой тип связи между атомами фосфора и хлора? Укажите тип гибридизации атома фосфора в молекуле PCl5.
64. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите примеры молекул с типично ионными связями и укажите тип кристаллической решетки. Составьте изоэлектронный ряд ксенона.
65. Согласно теории кристаллического поля определите, какой из ионов (CN- или H2O) влияет сильнее на энергию расщепления 3d-подуровня. Объясните образование комплексных ионов: низкоспинового [Fe(CN)6]4- и высокоспинового [Fe(H2O)6]2+ на основании теории кристаллического поля.
66. Приведите электронную конфигурацию молекулы NO по методу МО. Как изменяются магнитные свойства и прочность связи при переходе от молекулы NO к молекулярному иону NO+?
67. Какая связь называется s- и какая - p-связью? Какая из них менее прочная и более реакционноспособная? Изобразите структурные формулы этана C2H6, этилена C2H4 и ацетилена C2H2. Отметьте s- и p-связи на структурных схемах углеводородов.
68. Какие силы межмолекулярного взаимодействия называются диполь-дипольными (ориентационными), индукционными и дисперсионными? Объясните природу этих сил. Какова природа преобладающих сил межмолекулярного взаимодействия в каждом из следующих веществ: H2O, HBr, Ar, N2, NH3? 69. Какой тип гибридизации в молекулах CCl4, H2O, NH3? Изобразите в виде схем взаимное расположение гибридных облаков и углы между ними.
70. Приведите две схемы заполнения МО при образовании донорно-акцепторной связи в системах с атомными заселениями: а) электронная пара – свободная орбиталь (2+0) и б) электронная пара – электрон (2+1). Определите порядок связи, сравните энергии связей. Какая из рассмотренных связей участвует в образовании иона аммония [NH4]+?
71. Приведите четыре примера молекул и ионов с делокализованными связями. Изобразите их структурные формулы.
72. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа ABn, если связь в них образуется за счет sp-, sp2-, sp3- гибридизации орбиталей атома A? Приведите примеры молекул с указанными типами гибридизации.
73. На основании положений зонной теории кристаллов охарактеризуйте металлы, проводники и диэлектрики. От чего зависит ширина запрещенной зоны? Какие примеси нужно добавить к кремнию, чтобы превратить его в: а) n-полупроводник; б) р-полупроводник?
74. Приведите две схемы заполнения МО при взаимодействии двух АО с заселениями: а) электрон + электрон (1+1) и б) электрон + вакантная орбиталь (1+0). Определите ковалентность каждого атома и порядок связи. В каких пределах энергия связи? Какие из указанных связей в молекуле водорода H2 и молекулярном ионе
75. На основании строения атомов в нормальном и возбужденном состояниях определите ковалетность бериллия и углерода в молекулах BeCl2, (BeCl2)n, CO и CO2. Изобразите структурные формулы молекул.
76. Что такое дипольный момент? Как он изменяется в ряду сходно построенных молекул: HCl, HBr, HJ? Какой тип связи осуществляется между атомами водорода, хлора, брома и йода в приведенных молекулах? s- или p-связи в этих молекулах?
77. На основании строения атомов в нормальном и возбужденном состояниях определите ковалентность лития и бора в соединениях: Li2Cl2, LiF, [BF4]-, BF3.
78. Приведите электронную конфигурацию молекулы азота по методу МО. Докажите, почему молекула азота обладает большой энергией диссоциации.
79. Какая химическая связь называется координационной или донорно-акцепторной? Разберите строение комплекса [Zn(NH3)4]2+. Укажите донор и акцептор. Как метод валентных связей (ВС) объясняет тетраэдрическое строение этого иона?
80. Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью. Изобразите структурные формулы приведенных ассоциатов. Как влияет образование водородной связи на свойства веществ (вязкость, температуры кипения и плавления, теплоты плавления и парообразования, диэлектрическую постоянную)?
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 734; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |





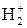 ?
?


