
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электродные процессы и гальванические элементыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Если металлическую пластину опустить в воду или электролит, то расположенные на ее поверхности катионы металла гидратируются полярными молекулами воды и переходят в воду или раствор электролита. При этом электроны, в избытке остающиеся в металле, заряжают примыкающий к поверхности слой отрицательно. Ввиду сил электростатического взаимодействия катионы металла, перешедшие в электролит, притягиваются к поверхности металла, образуя так называемый двойной электрический слой, по своему устройству напоминающий заряженный плоский конденсатор. Образовавшийся двойной электрический слой препятствует дальнейшему растворению металла и система металл-раствор переходит в состояние термодинамического равновесия. В этом состоянии между металлом и раствором возникает устойчивая разность потенциалов (скачок потенциала), называемая электродным потенциалом металла. Абсолютное значение электродного потенциала определить невозможно. Поэтому определяют относительные электродные потенциалы (разность электродного потенциала исследуемого металла и электрода сравнения). В качестве электрода сравнения выбран водородный электрод, потенциал которого при стандартных условиях (Т = 298 К, Р = 1 атм.) и [H+] = 1 моль/л принимается равным нулю. Стандартным электродным потенциалом металла (Е0) называют его электродный потенциал, возникающий при погружении металла в раствор собственных ионов с концентрацией 1 моль/л, измеренный по сравнению со стандартным водородным электродом. Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов, получаем «ряд напряжений металлов». Чем меньше значение Е0, тем более сильным восстановителем является металл. В электрохимических преобразователях энергии (гальванических и топливных элементах, аккумуляторах) протекают ОВР. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение.
Примеры решения задач Пример 1. Определите электродный потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л.
Решение. Электродный потенциал металла (Е) зависит от концентрации его в растворе. Эта зависимость выражается уравнением Нернста:
Е = Е0 + 0,059 lgC, n Е0 – стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; С – концентрация ионов металла в растворе, моль/л. Е0 для никеля равен – 0,25 В (из таблицы). Определим электродные потенциалы металла при данной концентрации: Е = - 0,25 + 0,059 lg10-3 = - 0,339 В. Пример 2. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, погруженные в растворы их ионов с концентрацией 1моль/л. Какой металл является анодом, какой - катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС. Решение. Схема гальванического элемента: (-) Mg ê Mg2+ êê Zn2+ êZn (+) Mg имеет меньший потенциал -2,37 В и является анодом, на котором протекает окислительный процесс: Mg – 2e- = Mg2+ (1) Цинк, потенциал которого -0,76 В, - катод, то есть электрод, на котором протекает восстановительный процесс: Zn2+ + 2е- = Zn0 (2) Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов: Mg + Zn2+ = Mg2+ + Zn0 Для определения ЭДС гальванического элемента из потенциала катода вычитаем потенциал анода. Концентрация ионов в растворе 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов: ЭДС = Е0катода – Е0анода = -0,763 - (-2,37) = 1,607 В.
Контрольные задания
241. Вычислите стандартную ЭДС гальванического элемента, составленного из магниевого и медного электродов. Напишите уравнение анодного и катодного процессов.
Ответ: 2,72 В
242. Вычислите ЭДС гальванического элемента, составленного из алюминиевой и медной пластин, погруженных в их одномолярные растворы. Напишите уравнения анодного и катодного процессов. Ответ: 2,03 В
243. Составьте схемы двух гальванических элементов, в одном из которых свинец является катодом, а в другом – анодом. Напишите для каждого из этих элементов уравнение анодного и катодного процессов. Рассчитайте стандартную ЭДС этих элементов.
244. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и водородного электрода, погруженного в раствор с рН=10. На каком электроде водород будет окисляться, а на каком - восстанавливаться?
Ответ: 0,59 В 245. По уравнению токообразующей реакции составьте схему гальванического элемента: Mg + ZnSO4 = MgSO4 + Zn Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС. Ответ: 1,607 В 246. Вычислите электродный потенциал медного электрода в растворе его соли с концентрацией 0,01 моль/л. Составьте схему гальванического элемента, в котором медь является анодом. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента. Ответ: 0,281 В 247. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
248. Составьте схему гальванического элемента из цинка и свинца, погруженных в растворы их солей с концентрацией ионов [Zn2+] = 0,01 моль/л, [Pb2+] = 1 моль/л. Ответ: 0,692 249. Вычислите ЭДС концентрационного гальванического элемента, электроды которого сделаны из серебра. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один серебряный электрод погружен в 0,01 М раствор, а другой – в 0,1 М раствор. Ответ: 0,059 В 250. Как изменится (увеличится, уменьшится) или останется постоянной масса свинцовой пластины, погруженной в раствор, содержащий соли Fe (II), Mg, Cu (II), Ag (I). Напишите молекулярные уравнения реакций.
251. Какой должна быть концентрация ионов [Zn2+] в полуячейке, чтобы пара Zn/Zn2+ при Т=298 К имела электронный потенциал - 0,819 В?
Ответ: 0,01 моль /л 252. Вычислите электродный потенциал водородного электрода в водном растворе кислоты с рН=3. Ответ: -0,177 В 253. Серебряный электрод в растворе его соли имеет электродный потенциал 0,623 В. Вычислите концентрацию ионов серебра в растворе. Ответ: 0,001 моль/л 254. ЭДС гальванического элемента, составленного из Ag и Cd электродов, при концентрации [Ag+] = 1 моль/л составила 1,32 В. Какой должна быть концентрация соли кадмия в растворе? Ответ: 1,28 моль/л 255. По уравнению токообразующей реакции Ni + CuSO4 = NiSO4 + Cu составьте схему гальванического элемента. Напишите уравнения катодного и анодного процессов. Рассчитайте стандартную ЭДС этого элемента. Ответ: 0,59 В 256. При какой концентрации ионов в растворе потенциал электрода Bi3+/ Bi равен 0,156 В? Ответ: 0, 01 моль/л 257. Составьте схему гальванического элемента, составленного из Mg и Co. Напишите уравнения электродных процессов. Вычислите ЭДС этого элемента, если [ Mg2+] = 1 моль/л, [ Co2+] = 0,1 моль/л. Ответ: 0,456 В 258. Какой должна быть концентрация соли железа Fe2+ в растворе, чтобы элемент (-) Fe / HCl / Cu (+) при [Cu2+] = 1 моль/л вырабатывал ЭДС = 0,839 В?
Ответ: 0,01 моль/л
259. Стандартный потенциал кобальта больше стандартного потенциала никеля. Изменится ли это соотношение, если изменить концентрации ионов никеля в растворе до 0,0001 моль/л, а кобальта – 0,1 моль/л?
260. Как работает свинцовый (кислотный) аккумулятор? Составьте уравнения полуреакций и зарядки – разрядки аккумулятора.
ЭЛЕКТРОЛИЗ Примеры решения задач Пример 1. При рафинировании меди ток силой в 50 А выделил - за 5 ч чистую медь массой 281 г. Какому выходу по току это соответствует?
Решение. По законам Фарадея можно рассчитать теоретическое значение массы выделившейся меди:
Выход по току находим по формуле:
Пример 2. Через раствор, содержащий ионы Pb2+, в течение 5 мин. пропускался ток постоянной силы. За это время масса катода увеличилась на 1,24 г. Какова сила тока, который был использован для электролиза? Решение. Поскольку нет дополнительных сведений, считаем выход по току 100%-ным. Тогда для расчета силы тока можно воспользоваться законом Фарадея:
Пример 3. Ток последовательно проходит через два электролизера, в которых содержатся водные растворы: а) NiSO4; б) FeCl2. Какие количества металлов выделятся на катодах, если известно, что у анода второго электролизера выделилось 1,4 л хлора? Решение. Воспользуемся законом эквивалентов для расчета массы железа, выделившегося на катоде второго электролизера:
Контрольные задания 261. При электролизе соли трехвалентного металла ток силой в 1,5 А в течение 2 часов выделил на катоде 2,09 г металла. Определите, какой это металл. Напишите уравнения катодного и анодного процессов, а также суммарное уравнение электролиза водного раствора ZnSO4 с платиновым и цинковым анодами. Ответ: железо 262. На электролиз водного раствора Na2SO4 израсходовано 10500 Кл электричества. Вычислите массу выделяющихся на угольных электродах веществ. Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза. Ответ:0,11 г и 0,87 г 263. При рафинировании меди током 1,5 А за 1,5 часа выделяется 2,5 г меди. Рассчитайте выход по току. Напишите уравнения катодного и анодного процессов, а также суммарное уравнение электролиза водного раствора Pb(NO3)2 : а) с угольным анодом; б) со свинцовым анодом. Ответ: 93% 264. Вычислите время, в течение которого должен быть пропущен ток в 1 А через раствор цинковой соли, чтобы покрыть пластину никелем массой 20 г. Выход по току 85%. Одинаковы ли продукты электролиза водного раствора BaCl2: а) с платиновым анодом; б) с цинковым анодом? Ответ подтвердите соответствующими уравнениями реакций. Ответ:21 час 265. Электрический ток силой 2 А пропускали в течение 1 ч 30 мин через водный раствор KI. Какие вещества и в каком количестве выделятся за это время на угольных электродах? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза.
Ответ:0,11 г и 14,2 г 266. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaCl течение 1ч 45 мин при силе тока 10 А? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза. Ответ: 0,65 г и 23,2 г 267. Как изменится за 1ч 20 мин масса цинкового анода при электролизе раствора Na3PO4 при силе тока 2,5 А? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза: а) с цинковым анодом; б) с угольным анодом. Ответ:4 г 268. Ток силой 2 А в течение 30 мин выделил 3,5 г свинца из раствора Pb(NO3)2. Вычислите выход по току. Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза водного раствора и расплава. Ответ: 91% 269. Какие вещества и в каких количествах образуются при электролизе расплава 117 г NaCl? Сколько времени будет длиться электролиз, если сила тока равна 2,5 А? Одинаковы ли продукты электролиза водного раствора NaCl: а) с угольным анодом; б) с кадмиевым анодом? Ответ подтвердите соответствующими уравнениями реакций. Ответ: 21 час; 46 г и 71 г 270. Найдите объем водорода, который выделится при пропускании тока силой в 2 А в течение 1,5 ч через водный раствор серной кислоты. Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза водного раствора и расплава Na2SО4 с инертным анодом. Ответ: 1,25 л 271. Сколько времени потребуется на электролиз раствора KCl при силе тока 1,5 А, чтобы выделить хлор объемом 11,2 л (н.у.), если выход по току составляет 85%? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза. Ответ: 21 час 272. При электролизе одного из соединений олова ток силой в 5А за 10 мин выделил на электродах металл массой 0,9 г. Чему равна валентность олова в этом соединении. Какие продукты могут быть получены при электролизе раствора K2SO4, если анодное и катодное пространства а) разделены пористой перегородкой; б) не разделены и раствор перемешивается? Ответ: 4 273. Сколько времени потребуется, чтобы нанести слой цинка массой 3,25 г, если сила тока 5,8 А, выход по току 83%? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза раствора NaBr: а) если анод графитовый; б) если анод цинковый. Ответ: 0,56 час 274. Какой силы ток следует пропустить через раствор в течение 1 час 35мин 15 сек, чтобы на катоде выделилось 1,2 л водорода? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза раствора К2S: а) если анод угольный, б) если анод кадмиевый. Ответ: 1,8 А 275. Ток последовательно проходит через два электролизера, в которых содержатся водные растворы: а) CoSO4; б) SnCl2. Какие количества металлов выделятся на катодах, если известно, что у анода второго электролизера выделилось 1,5 л хлора? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза раствора KF: а) если анод графитовый; б) если анод cвинцовый. Ответ:8 г; 3,9 г 276. Вычислите силу тока, зная, что при электролизе раствора NaОН в течение
Ответ: 13,9 А; 7,76 л 277. При пропускании тока в течение 10 минут через раствор серной кислоты выделяется 0,06 л гремучего газа (1 часть кислорода и 2 части водорода), измеренного при н.у. Какова сила тока? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза раствора NaI: а) если анод графитовый; б) если анод марганцевый. Ответ: 0,6 А 278. При какой силе тока можно получить на катоде 0,75 г кобальта, подвергая электролизу раствор СоSO4 в течение 35 мин? Какова масса вещества, выделившегося на аноде? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза раствора KB2О и расплава KOH с инертными электродами. Ответ: 1,2 А; 0,15 г 279. Амперметр, включенный последовательно с электролизером с раствором AgNO3, показывает силу тока 0,9 А. Верен ли амперметр, если за 15 мин выделилось 500 мг серебра? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза раствора и расплава ZnI2 с инертным анодом. Ответ: верен 280. Вычислите массы веществ, образующихся в прикатодном и прианодном пространстве, при электролизе раствора K3PO4 в течение 0,25 ч и силе тока 0,5 А. Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза. Ответ: 0,25 г и 0,44 г
КОРРОЗИЯ МЕТАЛЛОВ
Примеры решения задач Пример 1. Какими свойствами будут обладать оксидные пленки на металлах рубидии Rb и марганце Mn, образующих соответствующие оксиды R2O, MnO, Mn2O3, Mn3O4? Решение. Для определения свойств оксидных пленок воспользуемся формулой Бедворса – Пиллинга:
Оксидная пленка на рубидии не обладает защитными свойствами, т.к. не является сплошной.
Все оксидные пленки, образующиеся на марганце, являются сплошными и защитными, т.к. Пример 2. При коррозии бериллиевой пластины весом 300г и поверхностью 164мм, на воздухе прокорродировало 10% от массы бериллия в течение трех суток. Вычислите объемный показатель коррозии, считая, что продуктом коррозии является оксид бериллия, а внешние условия нормальными. Решение. Вычислим убыль массы бериллиевой пластины, т.е. сколько граммов бериллия прокородировало:
Составим уравнение реакции взаимодействия бериллия с кислородом и найдем из него объем поглощенного кислорода: 30г 2Ве + О2 = 2ВеО
18г/моль 22,4л
Вычислим объемный показатель, учитывая, что
Пример 3. Оценить коррозионную стойкость меди на воздухе при высокой температуре. Медная пластина размером 50х40х2мм после 12 суток окисления и снятия продукта коррозии весила 35,798 г. Решение. Вычислим площадь поверхности медной пластины:
Вычислим массу пластины до начала коррозии
Вычислим убыль массы медной пластины:
Вычислим глубину коррозии:
Вычислим глубинный показатель:
По десятибалльной шкале коррозионной стойкости металлов определяем, что в данных условиях меди соответствует 4 балла, и она относится к стойким металлам. Пример 4. Оценить коррозионную стойкость марганцевого стержня радиусом 1,5 мм и длиной 100 мм при температуре 1200оС в атмосфере азота в течение 20 суток, если при этом поглотилось 250 Решение. Вычислим объем поглощенного азота при нормальных условиях:
Вычислим по уравнению реакции массу прореагировавшего марганца:
Δm 0,0463 л 3Mn + N2 = Mn3N2
165 г 22,4 л
Вычислим площадь поверхности стержня:
Вычислим глубину коррозии:
Вычислим глубинный показатель коррозии:
По десятибалльной шкале коррозионной стойкости металлов определяем, что марганцу в данных условиях соответствует 6 баллов, и он относится к пониженностойким металлам. Контрольные задания 281. В каком случае цинк корродирует быстрее: в контакте с никелем или в контакте с висмутом? Ответ поясните. Напишите для обоих случаев уравнение электрохимической коррозии в кислой среде. Будет ли оксидная пленка, образующаяся на кальции, обладать защитными свойствами? Ответ: 0,63 282. Приведите примеры двух металлов, пригодных для протекторной защиты железа. Для обоих случаев напишите уравнение электрохимической коррозии во влажной среде, насыщенной кислородом. Будет ли оксидная пленка, образующаяся на алюминии, обладать защитными свойствами? Ответ: 1,3 283. Деталь сделана из сплава, в состав которого входит магний и хром. Какой из компонентов сплава будет разрушаться при электрохимической коррозии? Ответ подтвердите уравнениями анодного и катодного процесса коррозии: а) в кислой среде; б) в кислой среде, насыщенной кислородом. Будет ли оксидная пленка, образующаяся на олове, обладать защитными свойствами? Ответ: 1,3 284. С целью защиты от коррозии цинковое изделие покрыли кобальтом. Какое это покрытие: анодное или катодное? Напишите уравнение атмосферной коррозии данного изделия при нарушении целостности покрытия. Оценить коррозионную стойкость алюминия в олеуме, если убыль массы алюминиевой пластины размером 50х30х1 мм составила после 8 суток испытания 0,0341 г. Ответ: 0,18 мм/год 285. Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. Чем это можно объяснить? Какой участок металла, находящийся под влиянием капли, является анодным, а какой катодным? Составьте электронные уравнения соответствующих процессов. Будет ли оксидная пленка, образующаяся на никеле, обладать защитными свойствами? Ответ: 1,5 286. В подкисленный серной кислотой раствор бихромата калия поместили две железные пластины, одна из которых частично покрыта цинком, а другая - оловом. Напишите для обоих случаев уравнение анодного и катодного процессов. Будет ли оксидная пленка, образующаяся на вольфраме, обладать защитными свойствами? Ответ: 3,36 287. Сплав содержит олово и алюминий. Какой из названных компонентов будет разрушаться при атмосферной коррозии? Приведите уравнение анодного и катодного процессов. Оценить коррозионную стойкость цинка на воздухе при высоких температурах. Образец цинка размером 50х30х1 мм после 180 часов окисления и снятия продуктов коррозии весил 10,7032 г. Ответ: 0,015 мм/год 288. С целью защиты от коррозии магниевое изделие покрыли свинцом. Какое это покрытие: анодное или катодное? Напишите уравнения анодного и катодного процессов коррозии в кислой среде при нарушении целостности покрытия. Будет ли оксидная пленка, образующаяся на магнии, обладать защитными свойствами? Ответ: 0,79 289. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в азотной кислоте. Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами? Ответ: 1,12 290. Приведите примеры двух металлов, пригодных для протекторной защиты кадмия. Для обоих случаев напишите уравнение электрохимической коррозии в среде азотной кислоты. Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия размером 45х26х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,1032 г. Ответ: 0,015 мм/год 291. Деталь сделана из сплава, в состав которого входит алюминий и сурьма. Какой из компонентов сплава будет разрушаться при электрохимической коррозии? Ответ подтвердите уравнениями анодного и катодного процесса коррозии: а) в кислой среде; б) в кислой среде хромата калия, подкисленного соляной кислотой. Будет ли оксидная пленка, образующаяся на барии, обладать защитными свойствами? Ответ: 0,73 292. Если гвоздь вбить во влажное дерево, то ржавчиной покрывается та его часть, которая находится внутри дерева. Чем это можно объяснить? Анодом или катодом является эта часть гвоздя? Составьте электронные уравнения соответствующих процессов. Будет ли оксидная пленка, образующаяся на кобальте, обладать защитными свойствами? Ответ: 1,75 293. Цинковую и кадмиевую пластинки опустили в раствор соляной кислоты. Что при этом происходит? Напишите уравнения реакций. Что изменится, если концы пластин соединить проводником? Напишите соответствующие уравнения. Оценить коррозионную стойкость титана в концентрированной серной кислоте. Титановая пластина размером 80х40х0,5 мм весила после 6 суток испытания 7,2429 г. Ответ: 0,043 мм/год 294. Магний спаян с медью и находится во влажном воздухе. Напишите уравнения коррозии. Будет ли оксидная пленка, образующаяся на титане, обладать защитными свойствами? Ответ: 1,42 295. Серебро не вытесняет водород из соляной кислоты, но если к нему прикоснуться цинковой палочкой, то на серебре начинает бурно выделяться водород. Почему? Напишите электронные уравнения. Будут ли оксидные пленки, образующиеся на железе, обладать защитными свойствами? Ответ: 1,77; 2,14; 2,09 296. Какое покрытие: цинковое или никелевое надежней защитит железное изделие от коррозии? Почему? Напишите уравнения коррозии в кислой среде для обоих случаев. Будут ли оксидные пленки, образующиеся на уране, обладать защитными свойствами? Ответ: 1,96; 3,12 297. Чем отличается коррозия сплава, состоящего из меди и олова, в бензине, содержащем растворенный кислород и примеси серы, от коррозии этого же сплава в воде, содержащей растворенный кислород и ионы водорода? Напишите уравнения реакций для обоих случаев. Будет ли оксидная пленка, образующаяся на серебре, обладать защитными свойствами? Ответ: 1,58 298. Какой из перечисленных металлов: калий, олово, марганец или магний подойдет в качестве протектора для защиты кобальта? Напишите электронные уравнения процессов коррозии в кислой среде, содержащей растворенный кислород. Будет ли оксидная пленка, образующаяся на бериллии, обладать защитными свойствами? Ответ: 1,67 299. Медь покрыта серебром. Напишите уравнения электродных процессов во влажном воздухе при нарушении покрытия. Будет ли оксидная пленка, образующаяся на цинке, обладать защитными свойствами? Ответ: 1,59 300. Каковы продукты атмосферной коррозии оцинкованного железа и луженого железа? Напишите уравнения электродных процессов. Будут ли оксидные пленки, образующиеся на меде, обладать защитными свойствами? Ответ: 1,73; 1,66 301. Отличаются ли продукты коррозии сплава, состоящего из серебра и алюминия в соляной кислоте и соляной кислоте, содержащей растворенный кислород? Напишите соответствующие уравнения. Будет ли оксидная пленка, образующаяся на хроме, обладать защитными свойствами? Ответ: 2,04
Комплексные соединения
Примеры решений задач Пример 1. Вычислите заряды комплексных ионов, образованных платиной (IV): 1) [0,63]; 2) [ Решение. Степень окисления атома платины (комплексообразователя) равна +4, заряд молекулы аммиака (лиганда) равен нулю, а заряд хлорид-аниона (другого лиганда) равен -1; в итоге в соединении 1) - пентахлорамминплатине (IV) ([ Аналогичным образом находим заряды других комплексов: 2) в тетрахлордиамминплатине (IV) ([ 3) в дихлортетраамминплатине (IV) ([ В первом случае внешняя сфера содержит катионы, во втором – соединение является неэлектролитом, а в третьем – внешнюю сферу содержит анионы.
Пример 2. В результате приливания раствора Решение: Учтём, что прочность аммиачных комплексов значительно ниже, чем тиосульфатных: это видно из сравнения соответствующих констант нестойкости (см. табл. 3 Приложения). Реакция всегда протекает в направлении образования более прочного комплексного иона. В рассматриваемом случае уравнение реакции в молекулярной форме имеет следующий вид:
В полной ионно-молекулярной форме это уравнение записывается так:
Принимая во внимание, что ионы
Пример 3. Константа нестойкости иона Решение. Вторичная диссоциациякомплексного иона протекает по уравнению:
В присутствии избытка ионов По условию задачи:
В итоге определим концентрацию ионов
Пример 4. Растворы простых солей кадмия образуют с щелочами осадок гидроксида кадмия Решение. Из условий образования осадков
Учтём, что в растворе комплексной соли концентрацию ионов
Концентрация ионов
Следовательно, в рассматриваемой системе при концентрациях ионов Условие образования осадка сульфида кадмия из заданного раствора тетрацианокадмата калия отражает неравенство:
Таким образом, даже при малых концентрациях сульфид-иона равновесие
Контрольные задания
302. В чем заключается различие между комплексными и двойными солями с точки зрения ионной теории? Составьте уравнения диссоциации на ионы перечисленных ниже комплексных и двойных солей: Na3[Co(NO2)6]; [Cr(H2O)4Cl2]Cl; KCr(SO4)2; KMgCl3 . Назовите комплексные соли, укажите валентность и координационное число их комплексообразователей. При добавлении к каким из указанных солей раствора щелочи выпадет осадок гидроксида металла? 303. Составьте уравнение реакции в молекулярной и ионной формах, которые соответствуют следующим схемам: а) K2[HgCl4] б) K[Ag(NO2)2] Укажите, какие комплексные ионы в указанных схемах, исходные или конечные, характеризуются меньшими по величине константами нестойкости. Почему? 304. На комплексные соединения CoCl2·6NH3 и CoCl2·5NH3 подействовали раствором AgNO3. На полмоля одного соединения для осаждения хлора пошло полтора моля, а на полмоля второго – 1 моль AgNO3 . Укажите координационные формулы этих соединений и определите заряды комплексных ионов. 305. Составьте молекулярное уравнение реакции, протекающей по схеме: [Fe(CN)6]4- + MnO4- + 8 H+ Определите степени окисления комплексообразователей и напишите выражения констант нестойкости комплексных анионов. 306. Вычислите концентрацию катионов серебра в 0,1 Мрастворе соли [Ag(NH3)2]Cl. Назовите это соединение. Ответ: 2,1· 307. Из сочетаний частиц Zn2+, NH3, |
|||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1094; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.255.158 (0.014 с.) |

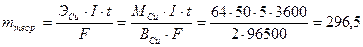 г
г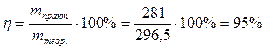 .
.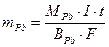 , отсюда
, отсюда  .
. . Переведем объем хлора в массу:
. Переведем объем хлора в массу: 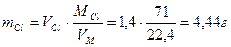 .
.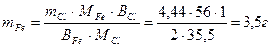

 Аналогично вычислим массу никеля, выделившегося на катоде первого электролизера:
Аналогично вычислим массу никеля, выделившегося на катоде первого электролизера:

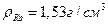

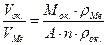

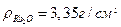
 <1
<1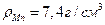

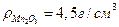
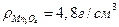
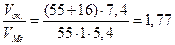 >1
>1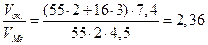 >1
>1 >1
>1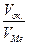 >1, но меньше 2,5.
>1, но меньше 2,5.
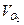
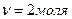
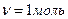
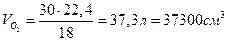
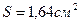 , а
, а 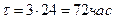 :
: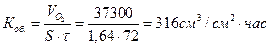
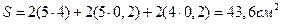
 :
:
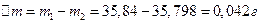
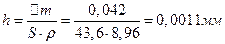
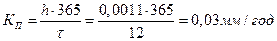
 азота.
азота.
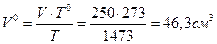


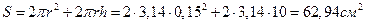
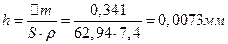

 ]; 3) [
]; 3) [ 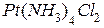 ]. Назовите эти соединения.
]. Назовите эти соединения.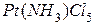 ]
] 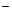 ) - суммарный заряд составляет +4 + (-5) = -1.
) - суммарный заряд составляет +4 + (-5) = -1. ) +4 + (-2) = +2.
) +4 + (-2) = +2. к раствору тиосульфата калия
к раствору тиосульфата калия  образуется комплексная соль
образуется комплексная соль 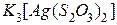 . Составьте уравнение реакции и укажите причину её протекания.
. Составьте уравнение реакции и укажите причину её протекания. ,
,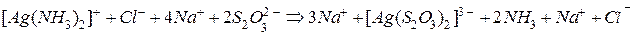 .
.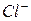 и
и  практически не изменяют своей концентрации в растворе, окончательно имеем:
практически не изменяют своей концентрации в растворе, окончательно имеем: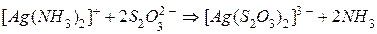 .
.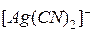 составляет
составляет  . Вычислить концентрацию ионов серебра в 0,05 M растворе
. Вычислить концентрацию ионов серебра в 0,05 M растворе  , содержащем, кроме того, 0,01 моль/л
, содержащем, кроме того, 0,01 моль/л 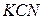 .
.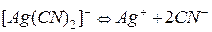 .
. , создаваемого в результате диссоциации
, создаваемого в результате диссоциации 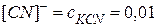 моль/л. По той же причине равновесная концентрация ионов
моль/л. По той же причине равновесная концентрация ионов 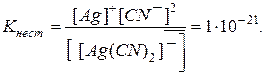
 :
: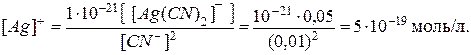
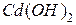 , а с сероводородом – осадок сульфида кадмия CdS. Чем объяснить, что при добавлении щёлочи к 0,05 M раствору
, а с сероводородом – осадок сульфида кадмия CdS. Чем объяснить, что при добавлении щёлочи к 0,05 M раствору  , содержащему 0,1 моль/л KCN, осадок не образуется, тогда как при пропускании через этот раствор сероводорода выпадает осадок CdS? Константу нестойкости иона
, содержащему 0,1 моль/л KCN, осадок не образуется, тогда как при пропускании через этот раствор сероводорода выпадает осадок CdS? Константу нестойкости иона 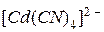 принять равной
принять равной 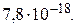
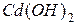 и CdS следует:
и CdS следует: ,
,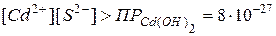 .
. можно аппроксимировать уравнением (см. пример 3):
можно аппроксимировать уравнением (см. пример 3):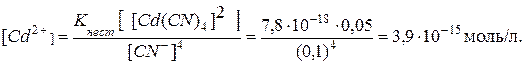
 , достаточная для осаждения гидроксида кадмия, может быть определена из неравенства:
, достаточная для осаждения гидроксида кадмия, может быть определена из неравенства: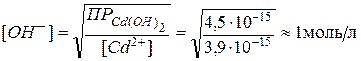 .
. , равновесие
, равновесие  смещено в сторону образования комплексного иона.
смещено в сторону образования комплексного иона.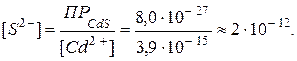
 практически полностью смещено в сторону образования сульфида кадмия.
практически полностью смещено в сторону образования сульфида кадмия.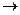 K2[HgI4];
K2[HgI4]; моль/л.
моль/л.


