
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определить абсолютные значения электродных потенциалов невозможно. Их можно только сравнивать.Содержание книги
Поиск на нашем сайте
В качестве электрода сравнения используется так называемый водородный электрод (рис.2),потенциал которого при стандартных условиях
(р=101,325КПа; Т=298К; активность ионов в растворе 1моль/л) принят равным нулю. Газообразный водород не проводит электрического тока, но, адсорбируясь на платиновой поверхности в кислой среде, образует электрод, аналогичный металлическому. Водород в виде ионов переходит в раствор, и устанавливается равновесие
При измерении электродных потенциалов металлов составляют гальванический элемент из водородного электрода сравнения (анод) и исследуемого металлического электрода (катод) при стандартных условиях. Измеряемая в этом случае ЭДС гальванического элемента
при Стандартные электродные потенциалы металлов сведены в таблицу (ряд напряжений) (см. табл. 5). При значениях активностей, отличных от 1 моль/л, равновесные электродные потенциалы рассчитываются по уравнению Нернста:
где: аМеп+ – активность ионов металла в растворе; R – универсальная газовая постоянная. При небольших концентрациях растворов, применяемых в лабораториях, активность можно заменить концентрацией и после подстановки значений констант и параметров получить расчетное уравнение в виде
Зависимость электродных потенциалов от концентрации широко используют для определения многих важнейших констант: произведения растворимости, константы нестойкости, ионного произведения воды, рН водных растворов. Для этих целей используют концентрационные цепи, в которых материал электродов одинаков, а отличны лишь концентрации растворов электролитов, содержащих соответствующие катионы. Например:
с1 < с2; Можно построить совершенно аналогичную окислительно-восстановительную цепь с участием только ионов в каждом из процессов окисления и восстановления, при этом электроды инертные, а продукты реакции остаются в растворе и не выделяются на электродах. Например, в гальваническом элементе типа
переход электронов осуществляется от электрода с KNO2 к электроду с KMnO4, о чем свидетельствует измеритель напряжения. Для того чтобы составить уравнение электродной реакции, можно воспользоваться электронно-ионным способом, включая в уравнение только участвующие в реакции ионы, которые образуются при диссоциации сильного электролита, и молекулы слабых электролитов, в том числе воды. Уравнивание следует производить путем прибавления или отнятия молекул воды (ионов ОН– или Н+ для щелочной или кислой среды соответственно). В приведенном примере анодом будет электрод с NO2–, а катодом – электрод с MnO4– в водном растворе. Поэтому реакция окисления на аноде записывается в виде NО2– + Н2О – 2е реакция восстановления на катоде принимает вид MnO4 – + 8Н+ + 5е Суммирование обеих полуреакций с учетом баланса электронов дает уравнение реакции в ионном виде:
2MnO4 – + 6Н+ + 5NО2–
или в молекулярном виде:
5KNО2 + 2KMnO4 + 3Н2 SO4 Величина потенциала каждого электрода может быть определена его сравнением с водородным электродом. Так как окислительно-восстановительные потенциалы зависят от концентраций, то такое сравнение принято проводить при концентрациях окисленной и восстановленной форм, равных 1 моль/л. В таблице стандартных окислительно-восстановительных потенциалов приводятся только потенциалы восстановления (для окислителя):
Электродная реакция, характеризующаяся меньшей величиной потенциала, определяет восстановитель и переписывается в обратном направлении; при этом знак потенциала меняется на обратный. Суммируя электродные потенциалы, можно определить величину ЭДС элемента, положительное значение которой подтверждает возможность самопроизвольного протекания реакции. По найденной величине Зависимость восстановительного потенциала от концентрации ионов определяемая уравнением Нернста, а именно:
включает концентрацию тех ионов, которые написаны в уравнении электродной реакции, характеризуемой восстановительным потенциалом, после знака равенства (свосст) или перед знаком равенства (сокисл). Концентрации окисленных и восстановленных форм ставятся в степенях их стехиометрических коэффициентов. Так, для потенциала электродов в приведенном выше случае следует записать
Окислительные свойства молекул или ионов тем сильнее, чем больше их потенциалы по алгебраической величине. Соотношения:
-nF
позволяют вычислить изменения свободной энергии
1.8.2. Электролиз
Электролизом называют окислительно-восстановительные реакции, протекающие на электродах при прохождении электрического тока через растворы или расплавы электролитов. При электролизе электрод, соединенный с отрицательным полюсом внешнего источника постоянного тока, называется катодом ( на нем идет восстановление), соединенный с положительным полюсом источника тока – анодом ( на нем идет окисление). В любом растворяемом в воде электролите под влиянием полярных молекул воды или под влиянием нагрева безводного электролита наблюдается процесс диссоциации его молекул на ионы. Поэтому при погружении в электролит электродов, соединенных с источником тока, происходит направленное перемещение ионов: катионов (положительно заряженных ионов) к катоду, анионов (отрицательно заряженных ионов) - к аноду. Например, при электролизе раствора или расплава хлорида натрия (NaCl) ионы Na+ перемещаются к катоду (К–), а ионы Cl- – к аноду (А+). Различают растворимые и нерастворимые аноды. К первым относятся аноды, изготовленные из угля, графита или благородных металлов (золота, платины, палладия и т.п.). В этом случае к анодам перемещаются анионы кислотных остатков, и протекает соответствующий окислительный процесс. Например:
К растворимым анодам относятся аноды, изготовленные из любых металлов, кроме благородных. В этом случае происходит окисление (растворение) самого анода. Например, на медном аноде протекает следующий процесс:
Для решения вопроса о составе полученных при электролизе продуктов необходимо учесть порядок восстановления катионов на катоде и анионов на аноде. Восстанавливающийся на катоде катион называется окислителем, окисляющийся анион – восстановителем. Руководствуясь вторым началом термодинамики, таблицей стандартных электродных потенциалов металлов и ее свойствами, утверждающими, что окислительная способность катионов возрастает сверху вниз, а восстановительная способность атомов металлов – снизу вверх, в простейших случаях можно установить следующий порядок восстановления катионов на катоде. В первую очередь восстанавливаются катионы металлов с наиболее положительными значениями стандартных электродных потенциалов (от золота до сурьмы включительно). Например:
Во вторую очередь преимущественно восстанавливаются катионы металлов, занимающих в ряду напряжений среднее положение (от вольфрама до марганца). Например:
Вместо всех остальных активных металлов, расположенных выше марганца, восстанавливаются молекулы воды с образованием на катоде газообразного водорода
Пользуясь рядом стандартных окислительно-восстановительных потенциалов, можно приближённо установить порядок окисления анионов на аноде: · В первую очередь окисляются анионы бескислородных кислот (S2-, I–, Br–, Cl–, CN–), за исключением иона фтора. Например:
· Во вторую очередь окисляются молекулы воды по уравнению: · В третью очередь окисляются анионы бескислородных кислот. Например: В случае растворимого анода происходит его окисление (см. выше). В случае протекания вышеперечисленных процессов по второму началу термодинамики система переходит в состояние с минимальным запасом энергии, т.е. её изобарно-изотермический потенциал Рассмотрим примеры различных случаев электролиза.
Примеры электролиза растворов электролитов С нерастворимыми анодами.
1. Электролиз раствора хлорида меди
Продукты, образующиеся при электролизе на электродах в результате электрохимических реакций, называются первичными продуктами электролиза. 2. Электролиз раствора сульфата цинка
Продукты, образующиеся в растворе у электродов в результате вторичных реакций соединения, называются вторичными продуктами электролиза. В данном примере это образовавшаяся у анода серная кислота. Цинк и кислород, образовавшиеся на электродах, - первичные продукты электролиза. 3. Электролиз раствора хлорида натрия
В приведённом примере первичными продуктами электролиза являются газы – водород и хлор, вторичными - гидроксид натрия, образовавшийся у катода. 4. Электролиз раствора сульфата натрия
В данном случае, как и при электролизе кислородсодержащих кислот и щелочей, образуется 2 первичных (водород и кислород) и 2 вторичных (щелочь и кислота) продукта. 5. Электролиз расплава хлорида натрия
Примеры электролиза растворов электролитов С растворимыми анодами.
6. Рафинирование (очистка от примесей) анода, изготовленного из меди с примесями Zn, Sn, Ag. Электролитом в этом случае служит раствор соли меди, анодом – медь, загрязненная примесями, катодом – графит или пластинка из чистой меди. Прилагаемое из внешнего источника напряжение не превышает стандартный электродный потенциал меди (
Для растворения серебра величина используемого напряжения недостаточна, и поэтому оно в нейтральном состоянии остается на дне электролизера в виде рыхлого осадка (в шламе). Для осаждения примесей на медном катоде требуется большое перенапряжение, и поэтому они остаются в растворе. Подобно рафинированию методом электролиза производится покрытие одного металла другим (гальваностегия), и наносятся металлические покрытия на неметаллические полупроводниковые подложки (гальванопластика). Приведенные примеры находят широкое применение в промышленности.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 271; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.34.148 (0.011 с.) |


 .
. (
( )
) отвечает стандартному электродному потенциалу металла
отвечает стандартному электродному потенциалу металла  .
.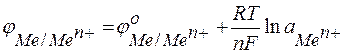 ,
, .
. ;
;
 NО3– + 2Н+,
NО3– + 2Н+,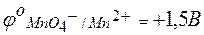

 можно рассчитать
можно рассчитать  и по уравнению изотермы Вант-Гоффа определить константу равновесия К, величина которой однозначно характеризует глубину протекания процесса.
и по уравнению изотермы Вант-Гоффа определить константу равновесия К, величина которой однозначно характеризует глубину протекания процесса.
 ;
; .
. =
=  Go = – RT lnK =
Go = – RT lnK = 



 , что связано с большим перенапряжением восстановления указанных металлов:
, что связано с большим перенапряжением восстановления указанных металлов:



 понижается
понижается  .
.













 0,4 В):
0,4 В):



