
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы защиты металлов от коррозииСодержание книги
Поиск на нашем сайте
В технике для защиты металлов от коррозии используются различные методы: · легирование · нанесение различных покрытий · электрохимическая защита · изменение свойств среды В зависимости от условий эксплуатации изделий может быть выбран тот или иной метод защиты от коррозии. В наиболее агрессивных средах (в морской воде, в почве и т.д.) применяют комбинированные методы защиты. Легирование металлов – это создание поверхностного экранирующего слоя, т.е. введение элементов, предотвращающих структурную коррозию. Неметаллические защитные покрытия – это лаки, краски, смазки, керамика, резина и т.п. Материалами для металлических защитных покрытий могут быть как чистые металлы (Zn, Cd, Al, Ni, Cr, Cu, Ag и др.), так и их сплавы (бронза, латунь). По характеру поведения металлических покрытий при коррозии различают катодные и анодные покрытия. Металлы анодного покрытия имеют меньшее (более отрицательное) значение потенциала, чем потенциал защищаемого металла; последний является в этом случае катодом и не коррозирует. Примером является оцинкованное железо. Катодными являются металлические покрытия, имеющие в данной среде большее значение потенциала, чем потенциал основного металла. Например, Sn, Cu, Ni, Ag на стали являются катодными покрытиями. При повреждении или наличии в покрытии пор возникают коррозионные элементы, в которых основной материал служит анодом и растворяется, а материал покрытия – катодом, на котором происходит выделение водорода или поглощение кислорода. Таким образом, катодные покрытия могут защищать металл в отсутствии пор или повреждений. К электрохимическим методам защиты относятся протекторная, катодная и анодная защита. Протектор – это кусок металла, имеющего более отрицательное значение стандартного электродного потенциала, чем металл защищаемого изделия, подключенный к защищаемому изделию. При воздействии агрессивной среды в первую очередь разрушается протектор. Для подавления процесса коррозии при катодной или анодной защите изделие подключают к источнику внешнего тока так, чтобы оно стало катодом (процесс коррозии подавляется) или анодом (в последнем случае устанавливается напряжение, соответствующее зоне пассивации на анодной поляризационной кривой, и поверхность изделия пассивируется).
Для изменения свойств агрессивной среды используют удаление окислителей из среды (деаэрация) или введение ингибиторов.
Примеры решения типовых задач Пример 1. Описание процесса коррозии металла и составление схемы гальванического элемента. Задача 1. Опишите процесс коррозии железной пластинки с включениями меди, опущенной в раствор соляной кислоты. Приведите схему образующегося при этом гальванического элемента. Решение. Исходя из положений металлов в ряду напряжений или по таблице сравнивая величины стандартных электродных потенциалов, видим, что железо является более активным металлом ( Схема работающего при коррозии гальванического элемента:
(-) Feo /Fe2+ || HCl || (Cu) H2 /2H+ (+)
Анодный процесс: Feo – 2е Катодный процесс: 2 H+ + 2е
Задача 2. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если пара металлов находится в кислой среде (в соляной кислоте). Приведите схему образующегося при этом гальванического элемента. Решение. Исходя из положений металлов в ряду напряжений или по таблице сравнивая величины стандартных электродных потенциалов, видим, что хром является более активным металлом ( Схема работающего при коррозии гальванического элемента
(-) 2Cro /2Cr3+ || HCl || (Cu) 3H2 /6H+ (+)
Анодный процесс: Cro – 3е Катодный процесс: 2 H+ + 2е Следовательно, окисляется хром. Задача 3. Опишите коррозионное поведения латуни (сплава цинка с медью) в кислой среде. Решение. На поверхности этого сплава присутствуют атомы меди и атомы цинка. Цинк имеет отрицательное значение потенциала
Коррозия латуни в кислой среде протекает по схеме:
(-) Zno /Zn2+ || H2SO4|| (Cu) H2 /2H+ (+) Анодный процесс: Zn – 2e Катодный процесс: 2H В кислых средах коррозионный процесс протекает с водородной деполяризацией, то есть деполяризатором (окислителем), способным снимать электроны с катодных участков, служат ионы водорода. Суммарное уравнение процесса коррозии латуни можно представить таким образом: Zn + H2SO4 Задача 4. Опишите коррозионное поведение стали (сплав железа с углеродом) во влажной атмосфере воздуха. Решение. На поверхности этого сплава присутствуют атомы железа и атомы углерода (точнее соединение железа с углеродом Fe3C) Железо имеет отрицательное значение потенциала (
анод (-) Feo /Fe2+ || O2 , H2O || C (+) катод
Анодный процесс: 2Feo – 4е Катодный процесс: O2 +2H2O+4e = 4OH– (восстановление).
Суммарное уравнение: 2Fe + O2 +2H2O = 2Fe(OH)2 – продукт коррозии. Продукт коррозии Fe(OH)2 кислородом воздуха окисляется до Fe(OH)3: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
1 O2 +2H2O+4e На воздухе из пленки гидроксида железа (III) частично испаряется вода и образуется рыхлый слоистый продукт – ржавчина: mFe2O3 .nH2О. Пример 2. Определение катодного и анодного типа защиты металла от коррозии. Задача 1. Опишите коррозионное поведение луженого и оцинкованного железа во влажной атмосфере воздуха. Какое железо (луженое или оцинкованное) более надежно защищено от коррозии. Решение. Железо, олово и цинк имеют следующие значения стандартных электродных потенциалов: –0,44 В, –0,14 В и –0,76 В соответственно. По сравнению с железом олово является менее активным металлом и будет служить катодным покрытием, т.е. надежно защищать металл в случае отсутствия пор или повреждений. При повреждении покрытия железо, являясь анодом, будет окисляться, а на поверхности катода (олова) будет протекать процесс восстановления (кислородная деполяризация):
анод (-)Feo /Fe2+ || O2, H2O || Sn/Sn2+ (+) катод
Анодный процесс: 2Feo – 4е Катодный процесс: O2 +2H2O+4e Продукт коррозии Fe(OH)2 кислородом воздуха окисляется до Fe(OH)3: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Цинк является металлом анодного покрытия, т.к. имеет меньшее (более отрицательное) значение потенциала, чем потенциал защищаемого металла; железо является в этом случае катодом и не коррозирует:
анод (-) Zno /Zn2+ || O2, H2O || Fe/Fe2+ (+) катод
Анодный процесс: 2Zn – 4e ® 2Zn Катодный процесс: O2 +2H2O+4e Продукт коррозии – Zn (OH)2. Таким образом, катодные покрытия могут защищать металл в отсутствии пор или повреждений, а анодные надежно защищают металл, так как сами окисляются.
1.10. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексными соединениями называются вещества, в структуре которых можно выделить центральный атом или катион металла, окруженный расположенными вокруг него в строгом геометрическом порядке заместителями. Основная особенность комплексных соединений – присутствие в их составе элементов, проявляющих дополнительные валентности. Как следствие, значение степеней окисления этих элементов не совпадают с их валентностями.
Другой отличительной особенностью комплексных соединений является наличие в них структурной группировки, называемой координационной сферой. Она состоит из центральной частицы – иона или атома – комплексообразователя и прочно связанных с ней заместителей – лигандов (от латинского ligare – связывать), которыми могут быть ионы противоположного знака, нейтральные молекулы, а также функциональные группы, принадлежащие к сложным молекулам или ионам. Число лигандов, расположенных вокруг комплексообразователя, называется координационным числом (КЧ). В формулах комплексных соединений координационная сфера выделяется квадратными скобками. Ее заряд равен алгебраической сумме зарядов комплексообразователя и лигандов. Противоионы, располагающиеся снаружи внутренней сферы, составляют внешнюю сферу комплексного соединения. Примерами комплексных соединений могут служить Na3[Al(OH)6], [Cr(H2О)6]Cl3, [Ni(NH3)6](NO3)2, K2[Zn(CN)4], Na2[Be(OH)4].
Комплексные соединения можно рассматривать как продукты объединения нескольких молекул обычных веществ: Al(OH)3.3NaOH, CrCl3.6H2O, Ni(NO3)2.6NH3, Zn(CN)2.2KCN, Be(OH)2.2NaOH. Образование комплексных соединений объясняется тем, что центральный ион (или атом) более сильно взаимодействует с лигандами, чем с другими имеющимися в молекуле частицами и поэтому удерживает лиганды около себя, образуя координационную сферу. Это взаимодействие обусловлено, в основном, тремя факторами: электростатическим притяжением, поляризацией и возникновением донорно-акцепторных связей за счет неподеленных электронных пар лигандов.
Пространственное расположение частиц в комплексном соединении Na3[Al(OH)6]. Как правило, комплексообразователями являются атомы или чаще катионы d-металлов, имеющие достаточное число вакантных орбиталей и выполняющие функции акцептора электронов при образовании связей с лигандами. Поэтому в качестве лигандов могут выступать частицы, являющиеся донорами электронов и содержащие на атоме–доноре частичный или целый отрицательный заряд. К таким частицам относятся отрицательно заряженные ионы F–, Cl–, OH–, CH3COO–, CN–, NO2–, CO32–, CNS–, и т.п.) или полярные молекулы (NH3, H2O, CO и т.п.), обладающие неподеленными парами электронов. Иногда функцию лигандов выполняют молекулы, имеющие p-электроны, например, бензол, алкены и алкины.
По составу координационной сферы комплексные соединения подразделяются на соединения, содержащие молекулярные лиганды, и соединения, содержащие анионные лиганды. К комплексным соединениям, содержащим молекулярные лиганды относятся: а) аквакомплексы или гидраты – комплексные соединения, в которых лигандами являются молекулы воды, например, [Cu(H2O)4]SO4, [Cr(H2O)6]Cl3, [Mg(H2O)6]SO4; б) аммиакаты – комплексные соединения, в которых в качестве лигандов выступают молекулы аммиака, например, [Pt(NH3)6]Cl4, [Zn(NH3)4]SO4, [Ag(NH3)2]Cl; в) карбонилы – комплексные соединения, в которых лигандами являются молекулы оксида углерода (II), например, [Fe(CO)5], [Ni(CO)4], [Co2(CO)8]. Последние являются примером комплексных соединений без внешней сферы. К комплексным соединениям, содержащим анионные лиганды, относятся: а) ацидокомплексы – комплексные соединения, в которых в качестве лигандов выступают кислотные остатки: Cl–, Br–, J–, CN–, NCS– и др., например, К3[Fe(CN)6], Na2[PtCl6], К2[HgJ4]; б) гидроксокомплексы – комплексные соединения, в которых в качестве лигандов выступают гидроксил-анионы, например, К3[Al(OH)6], Na2[Zn(OH)4), К2[Be(OH)4]. Согласно правилам IUPAC название комплексов включает название лигандов и комплексообразователя, причем вначале указываются лиганды (в алфавитном порядке), а затем комплексообразователь. К анионным лигандам добавляют окончание –о, например, CO32– – карбонато, NCS– – тиоцианато, NO2– – нитрито, CN– – циано, N3– – азидо, OH– – гидроксо. Нейтральные лиганды имеют те же названия, что и молекулы, за исключением H2O (аква), NH3 (аммин), СО (карбонил). Если в координационной сфере присутствуют различные типы лигандов, то они указываются в алфавитном порядке. Число лигандов в комплексе обозначают греческими приставками ди–, три–, тетра–, пента–, гекса– и т.д. Название комплексных анионов содержит суффикс –ат. Степень окисления металла–комплексообразователя указывается в круглых скобках после его названия. Если металл образует ион с одной степенью окисления, то она в название комплекса может не включаться. В целом название комплексного соединения состоит из названия внешней и внутренней сферы (комплекса). При этом как и в случае обычных неорганических соединений в начале указывается название аниона в именительном падеже, а затем катиона – в родительном. Если комплексное соединение не содержит внешней сферы, то указывается только его название в именительном падеже. Нижеприведенные примеры иллюстрируют изложенные правила: [Cr(NH3)6]Cl3 – хлорид гексаамминхрома (III); K4[Fe(CN)6] – гексацианоферрат (II) калия; [Co(NH3)3Cl3] – триамминтрихлорокобальт (III); [Cr(H2O)3F3] – триакватрифторохром (III); Na[Al(OH)4] – тетрагидроксоалюминат натрия; [CoCl2(H2O)(NH3)3]2SO4 – сульфат акватриамминдихлорокобальта (III). Как правило, комплексные соединения являются хорошими электролитами и легко диссоциируют в водных растворах на комплексные ионы и противоионы внешней сферы: К2[Zn(CN)4] [Co(NH3)6](NO3)2
При этом сами комплексные ионы достаточно устойчивы и диссоциируют в незначительной степени. Поэтому наиболее характерными реакциями комплексных соединений являются реакции обменного взаимодействия, в результате которых изменяется только внешняя сфера, а состав комплексной частицы остается неизменным. Примерами таких превращений являются реакции красной и желтой кровяной соли с водорастворимыми солями Fe(II) (уравнение а) и Fe(III) (уравнение б): а) 3FeSO4 + 2K3[Fe(CN)6] гексацианоферрат (III) гексацианоферрат (III) калия железа (II) (красная кровяная соль) (турнбулева синь) или в сокращенном ионном виде: 3Fe2+ + 2[Fe(CN)6]3–
б) 2Fe2(SO4)3 + 3K4[Fe(CN)6] гексацианоферрат (II) гексацианоферрат (II) калия железа (III) (желтая кровяная соль) берлинская лазурь) или в сокращенном ионном виде: 4Fe3+ + 3[Fe(CN)6]4– Прочность комплексных ионов в растворах характеризуется равновесием их диссоциации, например: [Zn(CN)4]2– [Co(NH3)6]2+ Мерой прочности комплексов является константа равновесия их диссоциации, которая называется константой нестойкости
Низкие значения этих констант указывают на высокую прочность комплексов, причем чем меньше Кнест., тем прочнее комплекс. Разрушение комплексов сводится к разрушению его координационной сферы. Принципиальный путь такого разрушения лежит через вовлечение свободных лигандов или ионов-комплексообразователей в новые реакции, обеспечивающие их связывание и смещение равновесия диссоциации комплексов в правую сторону. При этом эффективность разрушения комплексов должна оцениваться на основе анализа сложного равновесия, состоящего из равновесия диссоциации комплекса и равновесия связывания продуктов диссоциации.
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 364; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.28.200 (0.014 с.) |

 = –0,44 В) и в образующейся гальванической паре железо будет анодом. Медь является катодом (
= –0,44 В) и в образующейся гальванической паре железо будет анодом. Медь является катодом (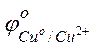 = +0,337 В). Железный анод растворяется, железо окисляется, а на медном катоде выделяется водород;
= +0,337 В). Железный анод растворяется, железо окисляется, а на медном катоде выделяется водород;  , следовательно, процесс протекает самопроизвольно.
, следовательно, процесс протекает самопроизвольно.
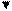
 Fe2+;
Fe2+; = –0,744 В), и в образующейся гальванической паре хром будет анодом. Медь является катодом (
= –0,744 В), и в образующейся гальванической паре хром будет анодом. Медь является катодом (
 = – 0,763 В), легче окисляется и служит анодом в коррозионном гальваническом элементе. Медь имеет положительное значение электродного потенциала (
= – 0,763 В), легче окисляется и служит анодом в коррозионном гальваническом элементе. Медь имеет положительное значение электродного потенциала (


 (окисление);
(окисление); + 2e
+ 2e  (ZnSO4) - продукт коррозии.
(ZnSO4) - продукт коррозии. 4 Fe(ОН)2 + ОН– +1e
4 Fe(ОН)2 + ОН– +1e  (окисление);
(окисление);





