
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение атома. Периодическая система химических элементов Д. И. Менделеева.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Периодичность свойств элементов и Их соединений.
Между положением элемента в периодической системе и строением атома этого элемента существует взаимно-однозначное соответствие, т.е. координаты элемента в периодической системе определяют строение атома и наоборот, по строению атома можно определить его положение в периодической системе. Для каждого элемента в периодической системе существует пять характеристик: порядковый номер Z, атомная масса А, номер периода, номер группы и подгруппа (главная или побочная). С точки зрения строения атома порядковый номер показывает число протонов в ядре. Атомная масса даёт сумму масс всех частиц атома: протонов, нейтронов и электронов. Учитывая, что масса электрона мала по сравнению с массой протона и нейтрона округлённо можно определять атомную массу, как сумму масс протонов и нейтронов. Отсюда легко найти число нейтронов в ядре как разность атомной массы и числа протонов: А – Z. Атом электронейтрален, поэтому число электронов в электронной оболочке равно числу протонов в ядре, т.е. порядковому номеру элемента – Z. Номер периода показывает число энергетических электронных уровней в атоме. Номер группы показывает общее число «валентных» электронов, т.е. электронов, которые могут принимать участие в образовании химических связей. Положение элемента в подгруппе (главной или побочной) определяется распределением «валентных» электронов: если элемент расположен в главной подгруппе, то все его валентные электроны находятся на последнем энергетическом электронном уровне, а все предыдущие уровни заполнены. Если элемент расположен в побочной подгруппе, то все остальные валентные электроны находятся на предпоследнем энергетическом уровне. Существует форма записи энергетических состояний электронов в атоме, которая называется электронной формулой. В ней главное квантовое число обозначается цифрой (1, 2, 3, 4…), орбитальное – буквой (s-, p-, d-, f-), а число электронов на каждом подуровне показывается индексом вверху, например, электронная формула атома азота
1s Основным или нормальным состоянием атома называется состояние, отвечающее минимальному запасу энергии, т.е. электроны занимают энергетические состояния с меньшей энергией. С небольшой затратой энергии (например, при воздействии светового излучения) электроны могут переходить в пределах одного энергетического уровня на более высокий энергетический подуровень. Атом переходит в «возбуждённое» состояние, например, для атома бериллия:
Строение внешних электронных уровней определяет формы и свойства его соединений. Например, для атома № 22 Ti имеем электронную формулу Ti имеет всего четыре валентных электрона, поэтому высшая степень окисления +4. Оксид, отвечающий этой степени окисления – TiO2, имеет амфотерный характер (с преобладанием основных свойств), поэтому соответствующий ему гидроксид может быть записан в двух формах: Ti(OH)4 или H2TiO3, соответственно он образует соли при взаимодействии и с кислотами и со щелочами:
Ti(OH)4 + 2Н2SO4 Ti(OH)4 + 2НCl
Низшая степень окисления Ti (как у большинства d–элементов) +2. Оксид TiО имеет основный характер, гидроксид Ti(OH)2 образует соли только с кислотами, например, TiSO4 или TiCl2. Для характеристики любого элемента необходимо выполнить следующие действия: 1. Определить состав атома, т.е. указать число протонов, нейтронов и электронов. 2. Дать электронную формулу атома и распределение электронов внешних энергетических уровней по атомным орбиталям. 3. Определить высшую и низшую степень окисления и привести формулы и названия соединений, отвечающих данным степеням окисления. Например, элемент № 34 Se. Состав атома: (34 p, 46 n) 34 e. Электронная формула: 1s22s22р63s23p63d104s24p4 – это p–элемент. Электронно-графическая формула:
Высшая степень окисления +6, оксид селена (VI) SeO3 – кислотный, гидроксид H2SeO4 - селеновая кислота, соли: Na2SeO4 - cеленат натрия, K2SeO4 - селенат калия. Низшая степень окисления -2, H2S - селеноводород, K2Se - селенид калия, Na2Se - селенид натрия. Свойства элементов, определяемые строением внешних электронных слоев атомов, закономерно изменяются по периодам и группам периодической системы. При этом сходство электронных структур порождает сходство свойств элементов–аналогов, но не тождественность этих свойств. Поэтому при переходе от одного элемента к другому в группах и подгруппах наблюдается не простое повторение свойств, а их более или менее ярко выраженное закономерное изменение. В частности, химическое поведение атомов элементов проявляется в их способности терять и приобретать электроны, т.е. в их способности к окислению и восстановлению. Количественной мерой способности атома терять электроны является потенциал ионизации(Еи), а мерой способности их п риобретать – сродство к электрону (Ес). Характер изменения этих величин при переходе от одного периода к другому повторяется, причем в основе этих изменений лежит изменение электронной конфигурации атома. Так, завершенные электронные слои, соответствующие атомам инертных газов, обнаруживают повышенную устойчивость и повышенное значение потенциалов ионизации в пределах периода. В то же время наименьшими значениями потенциала ионизации обладают s–элементы первой группы (Li, Na, K, Rb, Cs). Электроотрицательность является мерой способности атома данного элемента оттягивать на себя электроны по сравнению с атомами других элементов в соединении. Согласно одному из определений (Малликен), электроотрицательность атома В периодах наблюдается общая тенденция роста электроотрицательности элемента, а в подгруппах – ее снижение. Наименьшими значениями электроотрицательности обладают s–элементы I группы, а наибольшими – р–элементы VII группы. Электроотрицательность одного и того же элемента может меняться в зависимости от валентного состояния, гибридизации, степени окисления и пр. Электроотрицательность существенно влияет на характер изменения свойств соединений элементов. Так, например, серная кислота проявляет более сильные кислотные свойства, чем ее химический аналог – селеновая кислота, поскольку в последней центральный атом селена из-за меньшей по сравнению с атомом серы электроотрицательности не так сильно поляризует связи Н–О в кислоте, что и означает ослабление кислотности.
Н–О O
Другой пример: гидроксид хрома (II) и гидроксид хрома (VI). Гидроксид хрома (II), Cr(OH)2, проявляет основные свойства в отличие от гидроксида хрома (VI), Н2CrO4, поскольку степень окисления хрома +2 обусловливает слабость кулоновского взаимодействия Cr2+ с гидроксид-ионом и легкость отщепления этого иона, т.е. проявление основных свойств. В то же время высокая степень окисления хрома +6 в гидроксиде хрома (VI) обусловливает сильное кулоновское притяжение между гидроксид-ионом и центральным атомом хрома и невозможность диссоциации по связи
Н–О O
Следующей важной характеристикой атомов является их радиусы. В периодах радиусы атомов металлов с ростом порядкового номера элемента уменьшаются, т.к. с ростом порядкового номера элемента в пределах периода возрастает заряд ядра, а следовательно и уравновешивающий его общий заряд электронов; как следствие, возрастает и кулоновское притяжение электронов, что приводит в конечном счете к уменьшению расстояния между ними и ядром. Наиболее рельефно снижение радиуса наблюдается у элементов малых периодов, у которых происходит заполнение электронами внешнего энергетического уровня. В больших периодах у d- и f-элементов наблюдается более плавное снижение радиусов при увеличении заряда ядра атома. В пределах каждой подгруппы элементов радиусы атомов, как правило, увеличиваются сверху вниз, так как такое смещение означает переход на более высокий энергетический уровень. Влияние радиусов ионов элементов на свойства образуемых ими соединений можно проиллюстрировать на примере возрастания кислотности галогенводородных кислот в газовой фазе: HI > HBr > HCl > HF. В этих соединениях сила кулоновского притяжения зависит от кулоновского радиуса, представляющего собой сумму радиусов ионов галогена и водорода. Очевидно, что с ростом радиуса галогена сила кулоновского притяжения снижается, что делает отщепление протона более выгодным.
Примеры решения типовых задач. Пример 1. Составление электронных и электронно-графических формул атомов элементов, молекулярных формул соответствующих оксидов и гидроксидов по номеру элемента в периодической системе. Задача 1. Постройте электронные и электронно-графические формулы атомов элементов № 35 и № 73 и приведите молекулярные формулы образуемых ими оксидов, гидроксидов и солей. Решение. Электронные формулы показывают распределение электронов в атоме по энергетическим уровням и подуровням. Электронная формула обозначается символами Приложение этих правил к многоэлектронному атому приводит к следующей последовательности заполнения его энергетических уровней и подуровней: 1s®2s®2p®3s®3p®4s®3d®4p®5s®4d®5p®6s®(5d1)®4f® 5d®6p®7s® (6d3-2)®5f®6d®7p.
Положение элементов в периодической системе дает для него следующие характеристики: порядковый номер элемента, номер периода, номер группы, подгруппа (главная или побочная). Каждая из этих характеристик однозначно связана со строением атома элемента. Порядковый номер элемента указывает на число электронов, номер периода показывает на число энергетических уровней. Номер группы для элементов главных подгрупп указывает на число электронов на внешнем энергетическом уровне и на высшую положительную степень окисления. Для элементов побочных подгрупп номер группы указывает только на высшую положительную степень окисления, число же электронов на внешнем энергетическом уровне может быть 1 или 2. В связи с выше сказанным, электронные формулы для элементов №35 (Br) и №73 (Та) имеют следующий вид: 35Br 1s22s22p63s2 3p63d104s24p5 73Ta 1s22s22p63s2 3p63d 104s24p64d104f145s25p65d36s2 Электронная структура атома может быть изображена также графическим образом с помощью энергетических, или квантовых ячеек, которые являются схематическим изображением атомных орбиталей (АО).
Согласно правилу Хунда орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Графическая схема для указанных элементов имеет следующий вид:
35Br
73Ta
Br находится в VIIA группе, т.к. все валентные электроны у него находятся на внешнем энергетическом уровне. Следовательно, Br – неметалл, оксид брома (VII) Br2O7 проявляет свойства кислотного оксида, соответствующий ему гидроксид – бромная кислота HBrO4, соль пербромат натрия NaBrO4. Так как на внешнем энергетическом уровне 7 электронов, то приобретая один электрон, бром имеет низкую степень окисления –1. Соединения, соответствующие Тантал – d-элемент, поэтому он может проявлять переменную степень окисления и образует несколько оксидов и гидроксидов, причем характер их зависит от степени окисления. Для тантала наиболее типичны соединения, в которых их степень окисления равна +5. Оксид тантала (V) проявляет свойства кислотного оксида, его формула Та2О5, соответствующий ему гидроксид танталовая кислота НТаО3, соль КТаО3. Низшая степень окисления для тантала +2. Оксид и гидроксид Та(II) проявляет основные свойства. Соединения, соответствующие
Пример 2. Определение местонахождения элемента в периодической системе химических элементов по его электронной формуле. Задача 1. Определите элемент, его местонахождение в периодической системе, если его электронная формула имеет следующий вид: …5s25p2. Решение. Определить элемент и найти его местоположение в периодической системе можно двумя путями. Первый путь: определить число электронов, а оно укажет на порядковый номер элемента. Электронная формула, соответствующая этому элементу, имеет следующий вид: 1s22s22p63s23p63d104s24p64d105s25p2, т.к. число электронов равно 50, следовательно, это олово. Оно находится в 5 периоде, четвертой группе, главной подгруппе. Второй путь: этот элемент находится в 5 периоде, т.к. имеет строение внешнего энергетического уровня 5s25р2. На внешнем энергетическом уровне находится 4 электрона, следовательно, он находится в IVA группе. Элемент, соответствующий этим координатам – олово. Пример 3. Составление электронных формул атомов элементов на основе значений квантовых чисел электронов наружного слоя. Задача 1. Напишите электронную формулу атома элемента и назовите его, если значение квантовых чисел элементов наружного электронного слоя следующие: n=4, l=1, ml=-1, ms=+1/2; n=4, l=1, ml=0, ms=+1/2; n=4, l=1, ml=1, ms=+1/2. Решение. Состояние каждого электрона наружного энергетического уровня определяется следующим набором квантовых чисел:
Главное квантовое число равно четырем, следовательно, электроны находятся на 4-м энергетическом уровне. Орбитальное квантовое число определяет форму орбитали. Если l=1, то орбиталь называется р-орбиталью, следовательно, три электрона находятся на р-подуровне 4-го энергетического уровня. Магнитное квантовое число ml (-1, 0, +1) определяет ориентацию орбитали в пространстве. На всех трех р-орбиталях (px, py, pz) находится по одному электрону (ms =+1/2). Наружный энергетический уровень атома этого элемента содержит пять электронов: …4s24p3. Такую электронную конфигурацию наружного энергетического уровня имеет атом мышьяка As, электронная формула которого следующая: 1s22s22p63s23p63d104s24p3.
Пример 4. Составление электронных формул вещества на основе значения порядкового номера элемента. Задача 1. Составьте электронные формулы атома элемента с порядковым номером 40. Приведите распределение электронов атома этого элемента по квантовым (энергетическим) ячейкам. Решение. Элемент с порядковым номером 40 – цирконий Zr. Соответственно, на электронных уровнях и соответствующих им подуровнях (орбиталях) необходимо разместить 40 электронов. В соответствии с правилами заполнения многоэлектронного атома начинаем размещение электронов на нем с самого низкого энергетического уровня, n=1. Ему соответствует единственное значение орбитального числа l=0, определяющего сферическую форму орбитали (s-подуровень). Магнитное квантовое число, определяемое значением l (- l,...0,…+ l) также принимает для этого случая единственное значение ml=0, что демонстрирует наличие единственной орбитали (s-орбитали) на этом подуровне. Согласно правилу Паули на одной орбитали (и соответственно, на s-подуровне) может быт размещено максимум два электрона со спиновыми квантовыми числами ms=+1/2 и ms=-1/2. Поскольку рассматриваемый уровень (n=1) и соответствующий ему s-подуровень после размещения на нем двух электронов исчерпан (1s2), переходим к следующему энергетическому уровню n=2. Этому уровню соответствуют два подуровня, характеризующегося значениями l=0 и l=1. Как указывалось выше, значение l =0 определяет s-подуровень, на котором может быть размещено максимум два электрона 2s2. Следующий подуровень, определяемый значением l =1, называется р-подуровнем. Ему соответствует гантелеобразная форма орбитали (p-орбиталь). Для l =1 магнитное квантовое число принимает три значения -1, 0 и +1. Эти три значения определяют наличие на р-подуровне трех орбиталей, каждая из которых может принять максимум два электрона. Это означает, что на р-подуровне (l =1) можно разместить максимум шесть электронов (2р6). Итак, на двух первых энергетических уровнях (n=1, n=2) мы расположим 10 электронов: 1s22s22p6. Переходим к следующему уровню, n=3. На этом уровне находятся три подуровня, которым соответствуют значения l: 0, 1, 2 (l =0,1…..n-1). 3s-подуровень (l =0) этого уровня как любой s-подуровень содержит максимум 2 электрона (3s2). 3р-подуровень (l =1) – 6 электронов (3р6). При дальнейшем заполнении многоэлектронного атома возникает дилемма: куда размещать следующие электроны - на 3d (l =2) или 4s (l =0) подуровень? Здесь мы руководствуемся первым правилом Клечковского, согласно которому в первую очередь заполняется подуровень, которому соответствует меньшее значение суммы n+ l. Для 3d-подуровня эта сумма равна 3+2=5, а для 4s она равна 4+0=4. Поэтому заполняем 4s-подуровень 4s2. Далее необходимо решить дилемму, на каком подуровне размещать следующие электроны: 3d или 4р. Обоим этим подуровням соответствует одинаковое значение n+ l =5. Здесь мы руководствуемся вторым правилом Клечковского, согласно которому при равенстве суммы n+ l в первую очередь заполняется подуровень, которому соответствует меньшее значение n. Поэтому заполняет 3d-подуровень. Любой d-подуровень (l =2) содержит 5 орбиталей, которым соответствует набор значений m: -2, -1, 0, +1, +2. Максимальное число электронов, размещенных на этом подуровне, равно 5·2=10 (3d10). Таким образом, мы пришли к ситуации, когда полностью исчерпаны первые три уровня (n=1, n=2, n=3) и заполнен s-подуровень 4-го уровня: 1s22s22p63s23p63d104s2. При заполнении использовано 30 электронов, остается еще 10. Следующий подуровень, подлежащий заполнению, - 4р-подуровень (но не 5s – см. второе правило Клечковского). Ему соответствуют 3р-орбитали, на которых размещаем шесть электронов. Затем заполняем 5s-подуровень (два электрона) и приходим к ситуации 1s22s22p63s23p63d104s24p65s2. Остающиеся два электрона размещаем (руководствуясь первым правилом Клечковского) на 4d-подуровне и приходим к электронной формуле атома циркония: 1s22s22p63s23p63d104s24p64d25s2. Ей соответствует графическая электронная формула
При размещении последних электронов на 4d-подуровне использовано правило Гунда, согласно которому орбитали соответствующего подуровня заполняются сначала по одному электрону с одинаковым спином на разных орбиталях, а затем по второму электрону с противоположным спином на этих орбиталях.
Пример 5. Определение элементов по строению наружного и предпоследнего электронных слоев их атомов. Задача 1. Атомы каких элементов имеют следующее строение наружного и предпоследнего электронных слоев: а) 2s2p63s23p1; б) 3s23p63d34s2; в) 4s24p64d105s0. Решение. В случае а имеем дело с незаполненным р-подуровнем 3-го энергетического уровня, причем этот подуровень содержит один электрон и соответствует первому р-элементу 3-го энергетического уровня. Это 13Al. Его полная электронная формула 1s22s2p63s2p1. Случай б соответствует незаполненному d-подуровню 3-го энергетического уровня. Поскольку наружный слой содержит максимальное число s-электронов (4s2), то с учетом 3-х электронов на незаполненном 3d-подуровне, это соответствует 3-му по счету d-элементу 4-го периода, то есть 23V. Его полная электронная формула: 1s22s22p63s23p63d34s2. Случай в соответствует полностью заполненному 4d-подуровню (10 электронов), однако внешний 5s-подуровень пуст. Это означает, что произошел провал 2-х электронов с 5s- на 4d-подуровень, что соответствует восьмому по счету d-элементу (10-2=8) в пятом периоде. Этот элемент – 46Pd. Его полная электронная формула: 1s22s22p63s23p63d104s24p64d105s0.
Пример 6. Определение типа радиоактивного распада на основе баланса между массами и зарядами исходных частиц и конечных продуктов. Задача 1. Какой тип радиоактивного превращения имел место в следующих переходах ядер: а) 111Pd → 111Ag б) 222Rn → 218Po Решение. В случае а масса ядра сохраняется, но порядковый номер, а следовательно заряд ядра атома увеличивается на 1. Такая ситуация соответствует ß-распаду, поскольку в силу закона сохранения заряда увеличение заряда ядра атома на 1 должно быть сбалансировано единичным отрицательным зарядом, носителем которого является электрон (ß-частица). В то же время масса электрона пренебрежимо мала по сравнению с массой любого из нуклонов (протон или нейтрон), и ß-распад не приводит к изменению ядра атома:
В случае б масса полученного в результате ядерной реакции атома полония больше массы исходного радона на 4 единицы, а заряд ядра в результате ядерной реакции снижается на 2. Такое различие в массе и заряде соответствует выбросу
Пример 7. Изменение свойств элементов в больших периодах периодической системы. Задача 1. Каков характер изменения свойств элементов в четвертом периоде периодической системы? Решение. Четвертый период содержит 18 элементов от К (z=19) до Kr (z=36). В атомах элементов третьего периода заполнены электронами только s- и р-орбитали третьего энергетического уровня, десять d-орбиталей остаются свободными. Но у атомов элементов четвертого периода начинает заполняться электронами 4s-орбиталь (при наличии свободных d-орбиталей), так как ядро экранируется плотным электронным слоем 3s23p6. Заполнение d-оболочки третьего уровня начинается у Sc (z=21) и 3d1 и заканчивается у Cu (z=29) 3d10. Постепенное заполнение электронами d-орбиталей третьего уровня нарушается у атомов Cr и Cu, у которых происходит «провал» электрона в s-состоянии (с четвертого) внешнего энергетического уровня на предпоследний (третий). Десять элементов четвертого периода (Sc-Zn), в атомах которых застраивается d-оболочка третьего (предпоследнего) уровня, называют переходными. После цинка до криптона продолжается заполнение р-орбиталей четвертого энергетического уровня. В четвертом периоде между типичным металлом (К) и типичным неметаллом (Br) находятся 15 элементов (а не пять, как, например, в третьем периоде), из них 10 переходных элементов. Переходные элементы, в атомах которых заполняются d-оболочки предпоследнего уровня, меньше отличаются друг от друга по свойствам, чем элементы малых периодов. В больших периодах, в частности в четвертом, ослабление металлических свойств элементов происходит медленнее, чем в малых периодах (только в конце периода находятся неметаллы). В больших периодах большинство элементов – металлы.
Пример 8. Изменение свойств элементов в главных и побочных подгруппах периодической системы. Задача 1. Как изменяются металлические свойства элементов в главных и побочных подгруппах периодической системы с увеличением заряда ядра атома элемента? Решение. Главные подгруппы в группах периодической системы образуют s- и p-элементы, а побочные – d-элементы. В главных подгруппах с увеличением заряда ядра атома элемента увеличивается радиус атома элемента, так как в этом направлении возрастает число электронных слоев в атоме элемента. Поэтому в главной подгруппе сверху вниз нарастают металлические (восстановительные) свойства элементов. В побочных подгруппах при переходе от первого элемента ко второму происходит увеличение радиуса атома элемента, а при переходе от второго элемента к третьему даже некоторое уменьшение. Это объясняется f-(лантаноидным) сжатием. Поэтому в побочных подгруппах с увеличением заряда ядра уменьшаются металлические свойства (за исключением побочной подгруппы третьей группы). Поэтому в пределах одной группы свойства элементов главной и побочных подгрупп различны. Различия в свойствах элементов главных и побочных подгрупп значительны для первой группы, затем оно ослабевает. Так, элементы главной и побочной подгрупп третьей группы сравнительно близки по свойствам. Затем это различие в свойствах вновь усиливается и делается очень существенным в седьмой группе, где элементы подгруппы Mn сильно отличаются от галогенов.
Пример 9. Прогнозирование изменения свойств соединений элементов на основе изменения электроотрицательности этих элементов. Задача 1. Как изменится сила кислот в ряду HOCl → HOBr → HOI? Как изменятся окислительные свойства этих кислот? Решение. Свойством, определяющим силу кислот указанного ряда, является электроотрицательность атомов галогенов. Чем больше электроотрицательность галогена, тем в большей степени стабилизирован анион кислоты (О–Hal)–, образующийся в результате акта отдачи протона, то есть реализации кислотности. Поскольку электроотрицательность атомов галогенов изменяется в ряду Cl > Br > I, то кислотность кислот изменяется симбатно: HOCl > HOBr > HOI. В основе реализации окислительных свойств HOHal лежит также электроотрицательность, поскольку акту принятия электронов способствует способность атома притягивать электроны. Поэтому окислительные свойства этих кислот следуют ряду: HOCl > HOBr > HOI.
Пример 10. Прогнозирование изменения свойств соединений элементов на основе изменения радиусов этих элементов. Задача 1. Как изменяются основные свойства и растворимость в воде гидроксидов щелочных металлов в ряду LiOH → CsOH? Решение. Основность гидроксидов – способность их к отщепл
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 746; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.011 с.) |

 Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного
Фактически электронная формула есть распределение электронов по двум квантовым числам. Если же требуется дать распределение электронов по четырём квантовым числам, используют запись по энергетическим ячейкам или атомным орбиталям. Атомной орбиталью называется совокупность энергетических состояний электронов, характеризующихся определённым набором трёх квантовых чисел: главного, орбитального и магнитного  . Например, для атома азота электронно-графическая формула имеет вид:
. Например, для атома азота электронно-графическая формула имеет вид:
 , это d – элемент.
, это d – элемент.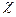 может быть выражена как полусумма его энергии ионизации и сродства к электрону:
может быть выражена как полусумма его энергии ионизации и сродства к электрону:  (Еи + Ес).
(Еи + Ес).
 Н–О O
Н–О O
 Se
Se – OH. С другой стороны, высокая степень окисления хрома в гидроксиде хрома (VI) усиливает его способность притягивать электроны, т.е. электроотрицательность, что обусловливает высокую степень поляризации связей Н–О в этом соединении, являясь предпосылкой увеличения кислотности.
– OH. С другой стороны, высокая степень окисления хрома в гидроксиде хрома (VI) усиливает его способность притягивать электроны, т.е. электроотрицательность, что обусловливает высокую степень поляризации связей Н–О в этом соединении, являясь предпосылкой увеличения кислотности. , где
, где  – главное квантовое число,
– главное квантовое число,  – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение –
– орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение –  ),
),  – число электронов в данном подуровне. В основе последовательности заполнения многоэлектронного атома лежит принцип наименьшей энергии, согласно которому в первую очередь заполняются орбитали с минимальным уровнем энергии. Реализация этого принципа осуществляется на основе правил Клечковского, и, согласно первому правилу, атомные орбитали заполняются электронами в порядке увеличения суммы
– число электронов в данном подуровне. В основе последовательности заполнения многоэлектронного атома лежит принцип наименьшей энергии, согласно которому в первую очередь заполняются орбитали с минимальным уровнем энергии. Реализация этого принципа осуществляется на основе правил Клечковского, и, согласно первому правилу, атомные орбитали заполняются электронами в порядке увеличения суммы  ; согласно второму – при равенстве суммы
; согласно второму – при равенстве суммы 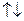
 : HBr, KBr.
: HBr, KBr. : ТаО, Та(ОН)2, Та(NO3)2.
: ТаО, Та(ОН)2, Та(NO3)2.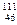 Pd →
Pd →  Ag + ß-
Ag + ß- -частицы:
-частицы: 



