
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Задачи к контрольной работе №2Содержание книги
Поиск на нашем сайте 1. Определите массу йода и объем спирта, необходимые для приготовления 300 г 10%-ного раствора йода (плотность спирта 0,8 г/мл). 2. Сколько граммов хлорида железа (III) необходимо для приготовления 2 л 0,5Н раствора? Определите титр этого раствора. 3. Вычислите молярную концентрацию раствора, в 0,04 л которого содержится 1,74 г сульфата калия. Определите титр этого раствора. 4. Водный раствор содержит 577 г серной кислоты в 1 литре, плотность раствора 1,335 г/мл. Определить массовую долю серной кислоты. 5. Вычислите молярную концентрацию 15%-ного раствора сульфата меди, плотность которого 1,107 г/мл. 6. Плотность 1,4 М раствора серной кислоты составляет 1,085 г/мл. Вычислите массовую долю серной кислоты. 7. Какое количество воды и нитрата калия необходимо для приготовления 400 г 20%-ного раствора? 8. Вычислите молярную концентрацию эквивалента (нормальность) 10%-ного раствора сульфата меди, плотность которого равна 1,107 г/мл. 9. Вычислите молярную концентрацию и молярную концентрацию эквивалента (нормальность) 16%-ного раствора хлорида алюминия плотностью 1,149 г/мл. 10. Определите молярную концентрацию раствора, полученного при растворении сульфата натрия массой 42,6 г в воде массой 300 г, если плотность полученного раствора равна 1,12 г/мл. 11. Определите молярную концентрацию и молярную концентрацию эквивалента (нормальность) 47,7%-ного раствора фосфорной кислоты, плотность которого равна 1,315 г/мл. 12. Вычислите, какие массы 60%-ного раствора и воды потребуются для приготовления 3 кг 10%-ного раствора некоторого вещества. 13. Какой объем раствора серной кислоты плотностью 1,8 г/мл с массовой долей Н2SO4 88% надо взять для приготовления раствора кислоты объемом 200 мл и плотностью 1,3 г/мл с массовой долей серной кислоты 40%? 14. Определить объем аммиака (условия нормальные), который необходимо растворить в 249 г воды для получения 25%-ного раствора гидроксида аммония. 15. Определить массу воды, в которой нужно растворить 188 г оксида калия для получения 5,6%-ного раствора гидроксида калия. 16. Определить массу 7,93%-ного раствора КОН, в котором нужно растворить 47 г оксида калия для получения 21%-ного раствора КОН. 17. Определить молярную концентрацию раствора, полученного при смешении 200 мл 8 М и 300 мл 2 М растворов серной кислоты. 18. Сколько граммов CuSO4 содержится в 10,0 мл 0,20 М раствора? Какова молярная концентрация эквивалента (нормальность) этого раствора? 19. Сколько миллилитров 60%-ного раствора серной кислоты, плотность которого 1,5 г/мл, нужно взять, чтобы приготовить 5,0 л 12%-ного раствора, плотность которого 1,08 г/мл? 20. Сколько миллилитров 30%-ного раствора гидроксида калия с плотностью 1,29 г/мл нужно взять, чтобы приготовить 3,0 л 0,50 М раствора? 21. До какого объема нужно разбавить 20,2 мл 20%-ного раствора хлорида меди (II), плотность которого 1,20 г/мл, чтобы получить 0,05 М раствор? 22. К 10 мл 12,8%-ного раствора хлорида бария, плотность которого 1,12 г/мл, прибавлен раствор сульфата натрия, в результате чего выпал осадок сульфата бария. Вычислите массу осадка. 23. К 3,5 М раствору хлорида аммония объемом 30 мл и плотностью 1,05 г/мл прилили 40 мл воды (плотность воды 1,00 г/мл). Определите массовую долю соли в полученном растворе. 24. Какой объем раствора с массовой долей карбоната натрия 15% (плотность 1,16 г/мл) надо взять для приготовления 0,45 М раствора карбоната натрия объемом 120 мл? 25. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NaHCO3 и NaOH; б) K2SiO3 и HCl; в) BaCl2 и Na2SO4. 26. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и HCl; б) FeSO4 и (NH4)2S; в) Cr(OH)3 и KOH. 27. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Mg2+ + CO32- = MgCO3; б) H+ + OH- = H2O. 28. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) КНСО3 и H2SO4; б) Zn(OH)2 и NaOH; в) CaCl2 и AgNO3. 29. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и H2S; б) BaCO3 и HNO3; в) FeCl3 и KOH. 30. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Cu2+ + S2- = CuS; б) SiO32- + 2H+ = H2SiO3. 31. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(OH)2 и HCl; б) BeSO4 и KOH; в) NH4Cl и Ba(OH)2. 32. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) СаСО3 + 2Н+ = Са2+ + Н2О + СО2; б) Al(OH)3 + OH– = [Al(OH4)]–; в) Pb2+ + 2I– = PbI2. 33. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Be(OH)2 и NaOH; б) Cu(OH)2 и HNO3; в) Zn(OH)NO3 и HNO3. 34. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и CaCl2; б) K2CO3 и BaCl2; в) Zn(OH)2 и KOH. 35. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Fe(OH)3 + 2H+ = Fe3+ + 3H2O; б) Cd2+ + 2OH– = Cd(OH)2; в) H+ + NO2– = HNO2. 36. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CdS и HCl; б) Сr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2. 37. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Zn2+ + H2S = ZnS + 2H+; б) НСО3– + Н+ = Н2О + СО2; в) Ag+ + Cl– = AgCl. 38. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) H2SO4 и Ba (OH)2; б) FeCl3 и NH4OH; в) СН3СООNa и HCl. 39. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и КОН; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3. 40. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Be(OH)2 + 2OH– = BeO 22– + 2H2O; б) СН3СОО– + Н+ = СН3СООН; в) Ba 2+ + SO 42– = BaSO4. 41. Какие из веществ: NaCl, NiSO4, Be(OH)2, KHCO3, взаимодействуют с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций. 42. Произведение растворимости сульфата кальция CaSO4 равно 43. Растворимость BaCO3 равна 44. Произведение растворимости PbI 2 равно 45. При t= 46. В 0,6 л насыщенного раствора PbSO4 содержится 0,186 г ионов свинца (II). Вычислите произведение растворимости этой соли. 47. Произведение растворимости Ag3PO4 равно 48. Произведение растворимости дихромата серебра Ag2Cr2O7 равно 49. Произведение растворимости сульфата свинца ПР ( 50. В пробирке при комнатной температуре смешаны 1,0 мл 0,2Н раствора нитрата свинца и 2,0 мл 0,01Н раствора хлорида натрия. Выпадет ли осадок, если ПР ( 51. Произведение растворимости иодида серебра 52. Во сколько раз концентрация водородных ионов в 0,1Н растворе HCl 53. Степень диссоциации H3PO4 по первой ступени в 0,1М растворе равна 0,17. Не учитывая диссоциацию по следующим ступеням, вычислите концентрацию водородных ионов в растворе. 54. Степень диссоциации NH4OH равна 1,3%. Сколько растворенных частиц (молекул и ионов) содержится в 1л такого раствора? 55. При какой молярной концентрации муравьиной кислоты HCOOH 95% ее молекул будут находиться в недиссоциированном состоянии, если КД = 56. Константа диссоциации сероводородной кислоты по первой ступени КД = 57. Вычислите степень диссоциации азотистой кислоты в ее 0,01 М растворе и концентрацию ионов водорода в растворе, если КД = 58. Какова концентрация водородных ионов [H+] в 0,1Н растворе синильной кислоты HCN, если ее константа диссоциации КД = 59. Определить степень диссоциации и концентрацию ионов [OH–] в 0,01Н растворе NH4OH, если КД = 60. Концентрация насыщенного при t= 61. Вычислите степень диссоциации 62. Определите рН 0,001 М раствора КОН, считая диссоциацию полной. 63. Концентрации ионов водорода в растворе 64. Определите рН раствора, в 3л которого содержится 65. Определите константу диссоциации кислоты, если водородный показатель (рН) в 0,08Н растворе одноосновной кислоты равен 2,4. 66. Чему равен рН 0,05 М раствора NH4OH, константа диссоциации которого 67. Какую величину называют степенью гидролиза соли? Какая из солей имеет большую степень гидролиза: 68. Почему изменение температуры раствора влияет на степень гидролиза соли? Составьте уравнения гидролиза по первой ступени для следующих солей: 69. При смешении растворов 70. Какую реакцию имеют растворы следующих солей: 71. В какую сторону сместится равновесие гидролиза 72. Почему растворы 73. Подберите по два уравнения в молекулярном виде к каждому из кратких ионных уравнений: а) б) в) 74. При сливании растворов 75. Водородный показатель (рН) 0,003Н раствора гипохлорита калия 76. Определите степень гидролиза (для первой ступени) и рН в 0,001М растворе 77. Составьте ионно-молекулярное и молекулярное уравнение гидролиза, происходящего при смешивании растворов К2S и CrCl3. 78. К раствору FeCl3 добавили следующие вещества: а) HCl; б) КОН, в) ZnCl2; г) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярное уравнение гидролиза соответствующих солей. 79. Какие из солей – Al2(SO4), K2S, Pb(NO3)2, KCl – подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (больше или меньше 7) имеют растворы этих солей? 80. При смешивании FeCl3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. 81. К раствору Na2CO3 добавили следующие вещества: а) HCl; б) NaOH; в) Cu(NO3)2; г) К2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. 82. Какое значение рН (больше или меньше 7) имеют растворы солей Na2S, AlCl3, NiSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 83. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Pb(NO3)2, Na2CO3, Fe2(SO4)3. Какое значение рН (больше или меньше 7) имеют растворы этих солей? 84. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СН3СООК, ZnSO4, Al(NO3)3. Какое значение рН (больше или меньше 7) имеют растворы этих солей? 85. Какое значение рН (7<рН<7) имеют растворы солей Na3PO4, K2S, CuSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 86. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей CuCl2, Cs2CO3, Cr(NO3)3. Какое значение рН (больше или меньше 7) имеют растворы этих солей? 87. К раствору Al2(SO4)3 добавили следующие вещества: а) H2SO4; б) КОН; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. 88. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3; FeCl3 или FeCl2? Почему? Составьте ионно-молекулярные уравнения гидролиза этих солей. 89. При смешивании растворов Al2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярные и молекулярные уравнения происходящего совместного гидролиза. 90. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: NaCN или NaClO; MgCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. 91. Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию. 92. При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. 93. На полное умягчение 500 мл воды израсходовали 0,53 г соды. Определить жесткость воды. 94. Жесткость воды обусловлена содержащимися в ней хлоридами кальция и магния. При действии на 5 л воды раствором, содержащим 5,3 г соды, образовалось 4,52 г карбонатов кальция и магния. Определить жесткость воды и массы хлоридов кальция и магния в исходном растворе. 95. Карбонатная жесткость воды равна 20 ммоль экв/л. При кипячении 60 л этой воды выделилось 54,2 г осадка – смеси карбоната кальция и карбоната гидроксомагния. Определить массовый состав осадка. 96. Определить жесткость воды, в 20 л которой содержится 4,44 г хлорида кальция. 97. Сколько граммов гидроксида кальция необходимо прибавить к 100 л воды, чтобы удалить временную жесткость, равную 2,86 ммоль экв/л? 98. Вычислите временную жесткость воды, зная, что на реакцию с гидрокарбонатом, содержащимся в 100 мл этой воды, потребовалось 5 мл 0,1Н раствора соляной кислоты. 99. Чему равна временная жесткость воды, в 1 л которой содержится 0,146 г гидрокарбоната магния? 100. Жесткость воды, содержащей только гидрокарбонат кальция, равна 1,785 ммоль экв/л. Определите массу гидрокарбоната в 1 л воды. 101. Сколько карбоната натрия надо добавить к 5 л воды, чтобы устранить общую жесткость, равную 4,6 ммоль экв/л? 102. В 1 литре воды содержится 38 мг ионов Mg2+ и 108 мг ионов Са2+. Вычислите общую жесткость воды. 103. Карбонатная жесткость воды равна 15 ммоль экв/л. Определите массы гидрокарбонатов кальция и магния в 10 л воды, если на их полное осаждение израсходовали 23,68 г гидроксида кальция. 104. При умягчении 1 л воды израсходовали 0,53 г соды. Определить жесткость воды. 105. Карбонатная жесткость воды равна 20 мэкв/л. При кипячении 50 л воды выделилось 27,0 г осадка – смеси карбоната кальция и карбоната гидроксомагния. Определить массовый состав осадка. 106. При осаждении карбонатов из 1 л воды израсходовали 0,265 г соды. Определите жесткость воды. 107. Определите жесткость воды, в 5 л которой содержится 2,22 г хлорида кальция. 108. Найдите временную жесткость воды, если на титрование 0,1 л образца воды, содержащей гидрокарбонат магния, израсходовано 7,2 мл 0,13 н. HCl. 109. Для устранения общей жесткости по известково-содовому методу к 50 л воды добавлено последовательно 7,4 г Са(ОН)2 и 5,3 г Na2CO3. Рассчитайте временную и постоянную жесткость воды. 110. Вычислите обменную емкость сульфоугля, если через адсорбционную колонку, содержащую 50 г сульфоугля, пропущено 11,35 л воды с общей жесткостью 8,5 ммоль экв/л. 111. Чему равна жесткость воды, содержащей 0,005 моль/л CaCl2? 112. Напишите уравнение окислительно-восстановительной реакции, подберите коэффициенты, составив ионно-электронный баланс: 113. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Какое свойство проявляет нитрит калия в данной реакции? Напишите уравнение окислительно-восстановительной реакции, составив ионно-электронный баланс:
114. Закончите следующее уравнение окислительно-восстановительной реакции, подберите коэффициенты, составив ионно-электронный баланс: 115. Исходя из степени окисления хрома в молекуле дихромата натрия, определите, какими свойствами обладает данное соединение. Напишите окислительно-восстановительную реакцию, составив ионно-электронный баланс: 116. Составьте ионно-электронные уравнения и на основании их подберите коэффициенты в уравнениях следующих реакций: а) 117. Исходя из степени окисления серы в сульфиде железа и азота в азотной кислоте, определите, какое вещество является окислителем, какое восстановителем, составьте ионно-электронные уравнения и расставьте коэффициенты в следующей реакции:
118. Напишите окислительно-восстановительную реакцию, подберите коэффициенты, составив ионно-электронный баланс. Какие свойства проявляет нитрит калия в данном процессе:
119. Составьте ионно-электронные уравнения и подберите коэффициенты для следующих окислительно-восстановительных реакций: а) б) 120. Исходя из степеней окисления серы, азота, определите, какими свойствами обладают вещества, участвующие в приведенных ниже окислительно-восстановительных реакциях. Составьте ионно-электронные уравнения, подберите коэффициенты: а) 121. Закончите уравнения реакций внутримолекулярного окисления-восстановления, подобрав коэффициенты: а) 122. Составьте уравнения реакций диспропорционирования: а) 123. Закончите уравнения реакции внутримолекулярного окисления-восстановления, подобрав коэффициенты у реагирующих веществ: а) 124. Напишите уравнение реакции взаимодействия, подберите коэффициенты методом электронно-ионного баланса в окислительно-восстановительной реакции между иодидом калия и пероксидом водорода, если при этом образуются молекулярный йод и едкое кали. 125. Напишите окислительно-восстановительную реакцию, составьте ионно-электронный баланс, определите молярную массу эквивалента восстановителя:
126. Определите молярную массу эквивалента окислителя, написав окислительно-восстановительную реакцию электронно-ионным методом:
127. Сколько литров хлора (н.у.) можно получить из 200,0 г поваренной соли, если реакция идет по уравнению:
128. Какой объем 0,2Н раствора
129. Какая масса сульфита натрия 130. К подкисленному раствору иодида калия
131. Напишите уравнение реакции, составив ионно-электронный баланс. Рассчитайте ЭДС, используя величины Red–Ox-потенциалов:
132. Составьте уравнение окислительно-восстановительной реакции, на основании ионно-электронного баланса подберите коэффициенты, рассчитайте ЭДС и определите возможность протекания реакции, пользуясь величинами Red–Ox-потенциалов:
133. В каком направлении будет протекать реакция 134. Возможна ли реакция между 135. В каком направлении будет протекать реакция
136. Можно ли использовать перманганат калия б) в) 137. Можно ли при стандартных условиях окислить в щелочной среде
138. Будет ли при стандартных условиях протекать следующая реакция:
139. Можно ли при стандартных условиях окислить хлороводород до хлора
140. Какой из окислителей:
141. Составьте уравнения реакций: а) получения гидрида калия; б) взаимодействия гидрида калия с водой. Какой газ и в каком объеме получится при взаимодействии 5,3 г гидрида калия с водой? 142. Пропуская водяной пар над раскаленным углем, получают водяной газ. Какой объем водяного газа (н.у.) можно получить из 2,5 кг угля, содержащего 30% примесей? 143. Какой объем водорода, измеренный при 144. Составьте уравнения реакций взаимодействия пероксида водорода: а) с дихроматом калия в кислой среде; б) с хромитом натрия в щелочной среде. 145. К подкисленному водному раствору иодида калия добавили 50 г водного раствора пероксида водорода. В результате реакции выделилось 20 г йода. Каково содержание (%) пероксида водорода в растворе? 146. Колба вместимостью 0,75 л, наполненная кислородом, при 147. Какими химическими свойствами обладает озон? Закончите уравнения реакций: а) 148. Как можно получить озон из кислорода? Какова объемная доля (%) озона в озонированном кислороде, если после разложения озона объем озонированного кислорода увеличился на 5%? 149. Какая масса раствора с массовой долей 150. Сколько литров кислорода можно получить из 0,75 кг пероксида натрия при действии на него диоксида углерода? 151. Закончите уравнения химических реакций: а) К каждой из реакций составьте электронно-ионную схему и рассчитайте ЭДС. 152. Сколько граммов белильной извести 153. Составьте уравнения реакций, которые надо провести, чтобы осуществить превращения:
154. Какие продукты образуются при разложении 1,23 г бертолетовой соли по двум возможным вариантам (в присутствии катализатора и без катализатора) и какова их масса? 155. Какова массовая доля 156. Сколько литров фтора надо пропустить через раствор 157. Реакции выражаются схемами: а) H2S + Cl2 + H2O → H2SO4 + HCl; б) K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O. Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. 158. Реакции выражаются схемами: а) KClO3 + Na2SO3 → KCl + Na2SO4; б) KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. 159. Могут ли происходить окислительно-восстановительные реакции между веществами: а) PH3 и HBr; б) K2Cr2O7 и H3PO3; в) HNO3 и H2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: AsH3 + HNO3 → H3AsO4 + NO2 + H2O. 160. Реакции выражаются схемами: а)P+ HClO3 + H2O → H3PO4 + HCl; б) H3AsO3 +KMnO4 →H3AsO4 + MnSO4 + K2SO4 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите окислитель, восстановитель, процесс окисления и процесс восстановления. 161. Реакции выражаются схемами: а ) NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O;б) FeS + HNO3 → Fe(NO3)2 + S + NO + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. 162. Реакции выражаются схемами: а) HNO3 + Zn → N2O + Zn(NO3)2 + H2O; б) FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl +H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите окислитель, восстановитель, процесс окисления и процесс восстановления. 163. Реакции выражаются схемами: а) K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl +H2O;б) Au + HNO3 + HCl → AuCl3 + NO + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. 164. Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и KMnO4; б ) HNO2 и HI; в) HCl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O. 165. Реакции выражаются схемами: а) HCl + CrO3 → Cl2 + CrCl3 + H2O; б) Cd + KMnO4 + H2SO4 → CdSO4 + MnSO4 + K2SO4 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. 166. Реакции выражаются схемами: а) Cr2O3 + KClO3 + KOH → K2CrO4 + KCl + H2O; б) MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. 167. Реакции выражаются схемами: а) H2SO3 + HClO3 → H2SO4 + HCl; б) FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O. Составьте электронно-ионные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое в
|
||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 564; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.013 с.) |

 . Выпадет ли осадок, если смешать равные объемы 0,01Н раствора CaCl2 и 0,02Н раствора Na2SO4?
. Выпадет ли осадок, если смешать равные объемы 0,01Н раствора CaCl2 и 0,02Н раствора Na2SO4? моль/л. Вычислите произведение растворимости карбоната бария.
моль/л. Вычислите произведение растворимости карбоната бария. . Вычислите концентрацию ионов Pb 2+ и ионов I – в насыщенном растворе иодида свинца.
. Вычислите концентрацию ионов Pb 2+ и ионов I – в насыщенном растворе иодида свинца. C в 1л насыщенного раствора иодида серебра AgI содержится 0,044г соли. Вычислите произведение растворимости этой соли.
C в 1л насыщенного раствора иодида серебра AgI содержится 0,044г соли. Вычислите произведение растворимости этой соли. . Вычислите концентрацию ионов Ag+ и PO4 3– в насыщенном растворе этой соли.
. Вычислите концентрацию ионов Ag+ и PO4 3– в насыщенном растворе этой соли. . Выпадет ли осадок при смешивании равных объемов 0,01Н растворов AgNO3 и K2Cr2O7?
. Выпадет ли осадок при смешивании равных объемов 0,01Н растворов AgNO3 и K2Cr2O7?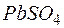 )=
)= 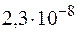 . Образуется ли осадок, если к 0,1М раствору Na2SO4 прибавить равный объем 0,1Н раствора ацетата свинца Pb(CH3COO)2?
. Образуется ли осадок, если к 0,1М раствору Na2SO4 прибавить равный объем 0,1Н раствора ацетата свинца Pb(CH3COO)2? )=
)= 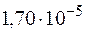 ?
? . Образуется ли осадок, если смешать равные объемы 0,02Н раствора KI и 0,04Н раствора AgNO3?
. Образуется ли осадок, если смешать равные объемы 0,02Н раствора KI и 0,04Н раствора AgNO3? больше, чем в 0,01Н растворе HCl
больше, чем в 0,01Н растворе HCl  ?
? ?
? . Определите концентрацию водородных ионов в 0,1 М растворе H2S.
. Определите концентрацию водородных ионов в 0,1 М растворе H2S.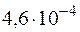 .
.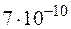 ?
? .
. C раствора сероводородной кислоты H2S составляет 0,13 моль/л. Константа диссоциации по первой ступени КД =
C раствора сероводородной кислоты H2S составляет 0,13 моль/л. Константа диссоциации по первой ступени КД =  . Определите концентрации ионов [H+] и [HS–].
. Определите концентрации ионов [H+] и [HS–]. и [H+] в 0,1 М растворе хлорноватистой кислоты, если КД =
и [H+] в 0,1 М растворе хлорноватистой кислоты, если КД = 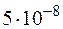 .
. моль/л. Определите рН и рОН раствора.
моль/л. Определите рН и рОН раствора. моль ионов ОН –.
моль ионов ОН –.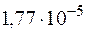 ?
? или
или  ? Ответ мотивируйте, составьте уравнения гидролиза солей в молекулярном и ионном виде.
? Ответ мотивируйте, составьте уравнения гидролиза солей в молекулярном и ионном виде. и
и  , укажите рН.
, укажите рН. и
и  в осадок выпадает гидроксид и выделяется газ. Укажите причину этого процесса и составьте соответствующие молекулярные и ионные уравнения.
в осадок выпадает гидроксид и выделяется газ. Укажите причину этого процесса и составьте соответствующие молекулярные и ионные уравнения. ;
;  ;
; 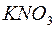 ;
;  ? Ответы подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.
? Ответы подтвердите, составив уравнения гидролиза в молекулярном и ионном виде. , если к раствору прибавить: а) щелочь; б) кислоту? Напишите уравнения гидролиза в молекулярном и ионном виде.
, если к раствору прибавить: а) щелочь; б) кислоту? Напишите уравнения гидролиза в молекулярном и ионном виде.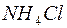 и
и  – кислую? Ответы подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.
– кислую? Ответы подтвердите, составив уравнения гидролиза в молекулярном и ионном виде.


 и
и  образуется осадок гидроксида хрома (III). Объясните причину этого явления и напишите соответствующие уравнения в молекулярном и ионном виде.
образуется осадок гидроксида хрома (III). Объясните причину этого явления и напишите соответствующие уравнения в молекулярном и ионном виде. равен 9,5. Вычислите степень гидролиза этой соли и напишите уравнения реакций гидролиза в молекулярном и ионном виде.
равен 9,5. Вычислите степень гидролиза этой соли и напишите уравнения реакций гидролиза в молекулярном и ионном виде. и
и 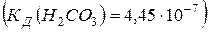 . Напишите уравнения реакций в молекулярном и ионном виде.
. Напишите уравнения реакций в молекулярном и ионном виде. .
.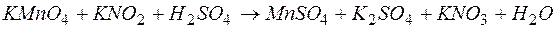 .
. …
… .
. ;б)
;б) 
 .
. .
. ;
;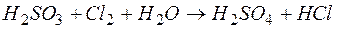 .
. ; б)
; б)  .
. ; б)
; б)  .
. ; б)
; б) 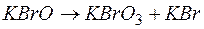 .
. ; б)
; б)  .
. .
.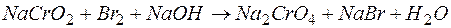 .
. .
. необходим для восстановления 0,05 л 0,1Н раствора
необходим для восстановления 0,05 л 0,1Н раствора  в кислой среде? Реакция идет по уравнению:
в кислой среде? Реакция идет по уравнению: .
.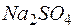 потребуется для восстановления 0,05 л 0,1Н раствора перманганата калия в присутствии серной кислоты? Реакция взаимодействия веществ протекает по уравнению:
потребуется для восстановления 0,05 л 0,1Н раствора перманганата калия в присутствии серной кислоты? Реакция взаимодействия веществ протекает по уравнению:  .
. добавили 0,04 л 0,03Н раствора нитрита калия
добавили 0,04 л 0,03Н раствора нитрита калия  (н.у.), если реакция протекает по уравнению:
(н.у.), если реакция протекает по уравнению: .
.
 ;
;  .
.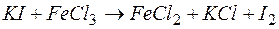
 ;
;  .
. , если
, если  ;
;  .
. и
и  в кислой среде, если
в кислой среде, если  ;
; 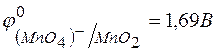 ?
? , если
, если ;
;  ?
? в качестве окислителя в следующих процессах при стандартных условиях, если
в качестве окислителя в следующих процессах при стандартных условиях, если  : а)
: а)  ;
;  ;
; ;
;  ;
; ;
; 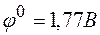 ?
?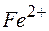 в
в  с помощью хромата калия
с помощью хромата калия  , если
, если ;
;  ?
? , если величины энергии Гиббса для реагирующих веществ следующие:
, если величины энергии Гиббса для реагирующих веществ следующие: ;
; 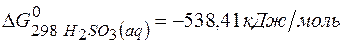 ;
; ?
? с помощью серной кислоты, если
с помощью серной кислоты, если ;
; 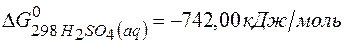 ;
; 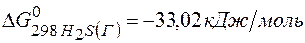 ;
;  ?
? или
или  лучше всего использовать для получения хлора из
лучше всего использовать для получения хлора из 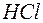 ? Стандартные Red – Ox-потенциалы равны:
? Стандартные Red – Ox-потенциалы равны: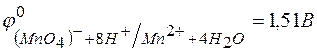 ;
;  ;
; 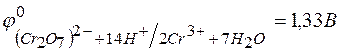 ;
;  .
. и
и  , необходимо затратить для получения 3,55 г молибдена из молибденового ангидрида
, необходимо затратить для получения 3,55 г молибдена из молибденового ангидрида  ?
?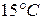 имеет массу 115,0 г. Масса пустой колбы 111,5 г. Определите давление газа в колбе.
имеет массу 115,0 г. Масса пустой колбы 111,5 г. Определите давление газа в колбе. …; б)
…; б)  …; в)
…; в)  …
… 2% необходима для получения 63,3 л дифторида кислорода?
2% необходима для получения 63,3 л дифторида кислорода? …; б)
…; б)  …; в)
…; в) 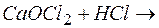 …
… может быть получено, если через раствор, содержащий 1,7 г гашеной извести, пропустить 5,6 л хлора?
может быть получено, если через раствор, содержащий 1,7 г гашеной извести, пропустить 5,6 л хлора?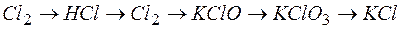 .
. (%) в растворе, если 0,15 кг раствора
(%) в растворе, если 0,15 кг раствора  в щелочной среде, чтобы получить 0,05 кг
в щелочной среде, чтобы получить 0,05 кг  . Вычислите молярную массу эквивалента восстановителя в этой реакции.
. Вычислите молярную массу эквивалента восстановителя в этой реакции.


