
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коррозия и защита металлов и сплавовСодержание книги
Поиск на нашем сайте
ОТ КОРРОЗИИ Коррозией называют самопроизвольное разрушение металлов и сплавов вследствие физико–химического взаимодействия их с окружающей средой. По механизму протекания процесса различают коррозию химическую и электрохимическую. Химическая коррозия протекает в неэлектропроводных средах (сухая атмосфера воздуха, растворы неэлектролитов). Химическая коррозия представляет собой непосредственное взаимодействие металла с окислителем, то есть процессы окисления и восстановления протекают одновременно и на одном и том же участке поверхности: 4Fe + 3O2 = 2Fe2О3 2 3 O2 + 4е
Электрохимическая коррозия протекает в электропроводных средах: растворы электролитов, влажная атмосфера воздуха (относительная влажность воздуха больше 65%). Наличие электропроводной среды делает возможной работу большого числа небольших по размеру гальванических элементов (микрогальванопар). Причиной образования на поверхности металла гальванических элементов является то, что большинство технически важных металлов имеют в своем составе примеси или даже специально вводимые добавки. Поэтому отдельные участки поверхности металла имеют более положительное, другие – более отрицательное значение потенциала (электрохимическая неоднородность поверхности). Основной причиной коррозии является термодинамическая неустойчивость металла или сплава в той или иной коррозионной среде. Критерием термодинамической вероятности коррозии является уменьшение изобарно - изотермического потенциала (
где: n - число электронов, принимающих участие в реакции; F - число Фарадея;
Если Приближенная оценка степени термодинамической нестабильности различных металлов в наиболее распространенных коррозионных средах может быть сделана по величине стандартных электродных потенциалов (см. таблицу «Стандартные электродные потенциалы металлов» Приложения), что примерно соответствует потенциалу окисления металла в анодном процессе Еа.
Наиболее распространенными коррозионными средами являются водные растворы электролитов, содержащие в качестве окислителя растворенный кислород или ионы водорода, то есть чаще всего коррозионный процесс протекает с кислородной или водородной деполяризацией. Величины потенциалов, соответствующих катодному процессу ЕК в наиболее распространенных коррозионных средах, представлены в таблице 1, в которой выделены 4 группы металлов, термодинамически неустойчивых в той или иной среде (∆G <0, если ЕК>ЕА). Особое место среди металлов занимает золото (ЕОAu/Au3+ = + 1,5В), которое является термодинамически устойчивым во всех наиболее распространенных коррозионных средах, указанных в таблице 1.
Таблица 1. Классификация металлов по термодинамической неустойчивости в различных средах
*Анодные процессы для всех металлов можно представить в общем виде: Ме – пе = Меп+
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 382; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.12.244 (0.007 с.) |

 2Fe – 6e
2Fe – 6e  2Fе3+ (окисление)
2Fе3+ (окисление) G < 0). В электрохимических процессах изменение изобарно - изотермического потенциала определяется по формуле
G < 0). В электрохимических процессах изменение изобарно - изотермического потенциала определяется по формуле ).
).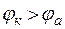 , то ∆G < 0, и процесс коррозии протекает самопроизвольно.
, то ∆G < 0, и процесс коррозии протекает самопроизвольно.


