
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Жесткость природных вод и ее устранениеСодержание книги
Поиск на нашем сайте
Мерой содержания в природных водах солей является жесткость воды. Природная вода, содержащая большое количество растворённых солей кальция, магния и железа, называется жёсткой. Различают общую, временную (карбонатную) и постоянную (некарбонатную) жёсткости. Общей жёсткостью называется суммарная концентрация ионов Ca2+, Mg2+ и Fe2+ в воде, выраженная в ммоль экв/л. Общая жёсткость воды равна сумме постоянной и временной жёсткости. Постоянной жёсткостью называется часть общей жёсткости, остающаяся после кипячения воды при атмосферном давлении в течение определённого времени. Постоянную жёсткость воды называют также некарбонатной жёсткостью, т.к. она обусловлена наличием сульфатов, хлоридов, силикатов кальция, магния и железа. Временной жёсткостью называется часть общей жёсткости, удаляющаяся кипячением воды при атмосферном давлении в течение определённого времени. Она равна разности между общей и постоянной жёсткостью. Временную жёсткость также называют карбонатной жёсткостью, т.к. она обусловлена наличием гидрокарбонатов кальция и магния.
По величине жёсткости воду делят на 6 классов.
Жёсткая водаоказывает вредное действие на технологические процессы и вызывает неприятные явления при использовании её в быту. Обработка воды, приводящая к снижению жесткости воды, называется умягчением воды. Существующие способы умягчения можно разделить на 3 группы: q реагентные (химические) методы умягчения воды. Химическая обработка воды основана на переводе растворимых солей кальция и магния в труднорастворимыее соли; В качестве реагентов–осадителей применяют известь, соду, едкий натр, фосфаты натрия и др. Чаще применяется сода в смеси с известью или едким натром; q умягчение воды методом ионного обмена (пропускание воды через ионообменные смолы); q термическое умягчение воды (кипячение).
Для устранения временной жёсткости воды применяют: – термическое умягчение (кипячение):
– реагентное умягчение гашёной известью:
Известь нейтрализует углекислоту, которая является одной из причин коррозии металлов, осаждает железо и способствует коагуляции коллоидов, например, кремниевой кислоты.
Для устранения общей жёсткости методом осаждения используют: – карбонат натрия (соду):
– фосфат натрия (тринатрийфосфат):
В последнее время для очистки воды стали широко применять иониты (ионообменные смолы). Метод ионного обмена – катионирование основан на фильтровании через слой катионита, при котором происходит замещение ионов Ca2 и Mg2+, содержащихся в воде, на катионы Na+, K+ или NH+4, содержащиеся в твёрдой фазе катионита. В качестве катионитов в основном применяют иониты КУ-I и КУ-2. В некоторых случаях требуется удалить из воды не только катионы Ca2+ и Mg2+, но и другие катионы и анионы. В таких случаях воду пропускают последовательно через катионит, содержащий в обменной форме водородные ионы (Н+-катионит) и анионит, содержащий гидроксильные ионы (ОН––анионит). В итоге вода освобождается как от катионов, так и от анионов солей. Такая обработка воды называется обессоливанием:
Обменная ёмкость
где: V- объём воды, пропущенный через катионит, л; m – масса катионита, г.
Общая жёсткость воды может быть рассчитана по формуле:
где: m1, m2, m3 – массы содержащихся в воде катионов кальция, магния (или соответствующих им солей), мг; Мэкв.1 , Мэкв.2 , Мэкв.3 – молярные массы эквивалентов металлов (или соответствующих им солей), г/моль экв; V– объём воды, л.
Примеры решения типовых задач. Пример 1. Расчет массовой доли, молярной концентрации и молярной концентрации эквивалента раствора. Задача 1. Определите массовую долю, молярную концентрацию и молярную концентрацию эквивалента раствора, полученного при смешении 200 мл 2М раствора серной кислоты ( Решение. Рассчитаем массу первого раствора и массу серной кислоты в нем: m(р-ра)1= m(H2SO4)1 = =2 . 0,2 . 98=39,2(г); Масса второго раствора и масса серной кислоты в нем равны m(р-ра)2 = m(H2SO4)2 = m(р-ра)2 . Массовую долю полученного раствора рассчитываем по формуле:
Молярная концентрация раствора
Пример 2. Растворение веществ, взаимодействующих с водой, инахождение концентрации полученного раствора. Задача 1. Найдите массовую долю вещества в растворе, полученном при взаимодействии 4,6 г металлического натрия с 75,6 мл воды. Решение. Запишем уравнение реакции взаимодействия натрия с водой: 0,2моль 0,2моль 0,1моль 2Na + 2H2O = 2NaOH + H2 2моль 2моль 1моль Рассчитаем количество вещества и массу NaOH:
m (NaOH) = М(NaOH) . Масса полученного раствора и массовая доля гидроксида натрия равны: m(р-ра)= m(H2O) + m(Na) – m(H2) =76,5 + 4,6 - 2 . 0,1=80 (г)
Пример 3. Составление ионно-молекулярных уравнений на основе данных о реагентах и продуктах реакции. Задача 1. Напишите ионно-молекулярные уравнения реакций взаимодействия между водными растворами: а) б) в) г) д) Решение. Запишем уравнения взаимодействия указанных соединений в молекулярной форме: а) б) в) г) д) Из рассмотренных примеров видно, что в каждой из реакций присутствует предпосылка для количественного связывания реагентов – образование осадков (PbS, BaSO4, Mg(OH)2), газов (CO2) или недиссоциированных соединений (H2O). Запишем каждую из этих реакций в ионно–молекулярной форме: а) б) в) г) д) Исключая одинаковые ионы из правых и левых частей уравнений, получаем их краткие ионно-молекулярные формы: а) б) в) г) д) Пример 4. Составление ионно-молекулярных уравнений на основе их ионно–молекулярных форм. Задача 1. Составьте молекулярные уравнения реакций, которым соответствуют ионно–молекулярные уравнения: а) б) в) г) д) Решение. В левой части приведенных ионно–молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации сильных электролитов. Поэтому при составлении молекулярных уравнений следует исходить из соответствующих водных растворов электролитов. Например: а) б) в) г) д) Пример 5. Определение растворимости электролита по величине произведения растворимости. Задача 1. Произведение растворимости Решение. Между осадком
Произведение растворимости, характеризующее это равновесие
Растворимость
Обозначим
т.е. растворимость
Пример 6. Вычисление произведения растворимости труднорастворимого электролита. Задача 1. Растворимость фосфата серебра Решение. Диссоциация (растворение) соли в воде характеризуется равновесием
Тогда Пример 7. Определение возможности образования осадка в зависимости от концентрации растворов. Задача 1. Произведение растворимости Решение. При смешении равных объемов растворов объем смеси стал в два раза больше объема каждого из взятых растворов, следовательно, концентрация растворенных веществ уменьшилась вдвое, т.е.
В соответствии с соотношением между количеством вещества (
Тогда
Пример 8. Вычисление константы гидролиза соли. Задача 1. Рассчитайте константу гидролиза хлорида аммония NH4Cl, если константа диссоциации NH4ОН равна Решение. Константу гидролиза соли слабого основания и сильной кислоты вычисляют по формуле
где Константа гидролиза NH4Cl равна
Пример 9. Вычисление степени гидролиза соли. Задача 1. Определите степень гидролиза Решение. Степень и константа гидролиза связаны между собой соотношением
Так как обычно степень гидролиза соли
КГ определяется из выражения (13):
Поскольку молярная и нормальная концентрации
Пример 10. Совместный гидролиз солей. Задача 1. Обоснуйте, почему совместный гидролиз водного раствора солей Решение. Каждая из указанных солей гидролизуется согласно уравнениям:
В результате этих процессов образуется пара кислота – основание
Пример 11. Определение жесткости воды. Задача 1. Вычислите жесткость воды, зная, что в Решение. В 1 л воды содержится 202,5 г: 500 = 0,405 г Пример 12. Определение содержания соли по жесткости воды. Задача 1. Сколько граммов Решение. Молярная масса Пример 13. Определение количества реагента для устранения жесткости воды. Задача 1. Какую массу соды необходимо добавить к 500 мл воды, чтобы устранить ее жесткость, равную Решение. Количество вещества эквивалентов солей, содержащихся в 500 мл воды, составляет
Согласно закону эквивалентов
Массу
Пример 14. Определение жесткости воды по известному количеству реагента, необходимого для устранения жесткости. Задача 1. Вычислите карбонатную жесткость воды, зная, что на титрование 100 мл этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 мл 0,08Н раствора НСl. Решение. В соответствии с законом эквивалентов
Количество вещества эквивалентов НСl определяем по формуле:
Поскольку
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 380; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.51.72 (0.011 с.) |

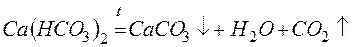


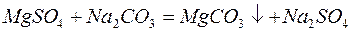

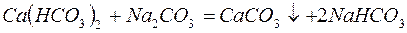
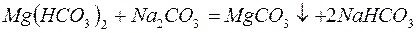
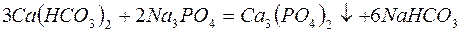


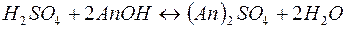
 катионита определяется из соотношения:
катионита определяется из соотношения: (ммоль экв/г),
(ммоль экв/г),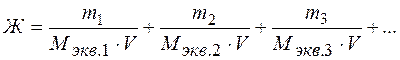 (ммоль экв/л)
(ммоль экв/л)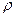 =1,18 г/мл) и 200 мл 8% раствора серной кислоты (
=1,18 г/мл) и 200 мл 8% раствора серной кислоты (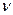 (H2SO4) . M(H2SO4)=c(H2SO4) . V(р-ра)1 . М(H2SO4)=
(H2SO4) . M(H2SO4)=c(H2SO4) . V(р-ра)1 . М(H2SO4)=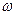 (H2SO4)=210 . 0,08 =16,8 (г).
(H2SO4)=210 . 0,08 =16,8 (г).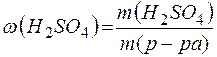 =
= 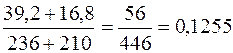 (12,6%)
(12,6%) ;
;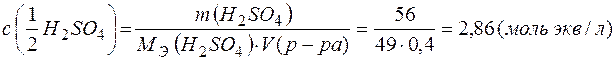
 (NaOH)=
(NaOH)= 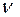 (Na) =
(Na) =  (моль);
(моль);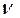 (NaOH)=40 . 0,2=8(г).
(NaOH)=40 . 0,2=8(г).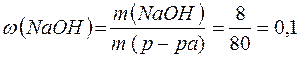 (10%).
(10%).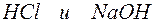
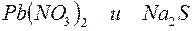

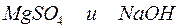
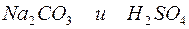

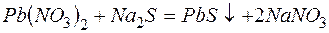
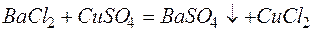


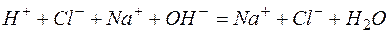

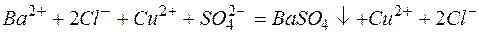
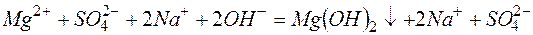

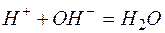

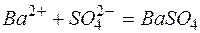
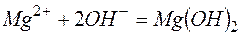
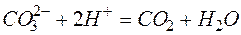
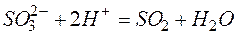



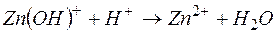


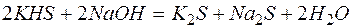


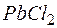 при
при 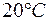 равно
равно 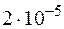 . Вычислите молярную концентрацию
. Вычислите молярную концентрацию 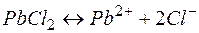 (28)
(28)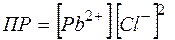 (29)
(29)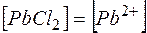
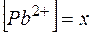 , тогда
, тогда 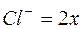 и
и 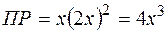 .
. и
и  ,
,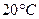 равна
равна  .
.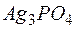 в воде при
в воде при 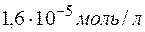 . Определить произведение растворимости этой соли.
. Определить произведение растворимости этой соли. , откуда видно, что
, откуда видно, что  .
. , а
, а  .
.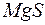 при
при 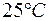 равно
равно 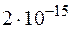 . Образуется ли осадок при смешении равных объемов
. Образуется ли осадок при смешении равных объемов 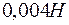 раствора
раствора 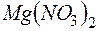 и
и  раствора
раствора 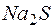 , если степени диссоциации этих электролитов равны 1?
, если степени диссоциации этих электролитов равны 1?
 .
.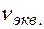 ) для этих солей, их молярные концентрации составят
) для этих солей, их молярные концентрации составят
 .
.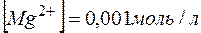 ,; отсюда произведение концентраций ионов
,; отсюда произведение концентраций ионов 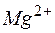 и
и  составит
составит 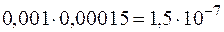 . Эта величина существенно больше
. Эта величина существенно больше  , следовательно, осадок образуется.
, следовательно, осадок образуется.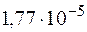 .
. ,
,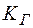 – константа гидролиза;
– константа гидролиза; 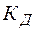 – константа диссоциации слабого основания;
– константа диссоциации слабого основания;  – ионное произведение воды.
– ионное произведение воды. .
.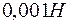 раствора соли
раствора соли  и
и  этого раствора, если константа диссоциации уксусной кислоты
этого раствора, если константа диссоциации уксусной кислоты 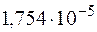 .
.
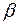 значительно меньше единицы, то
значительно меньше единицы, то  , откуда
, откуда (30)
(30) .
.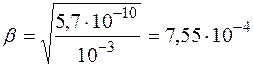 .
.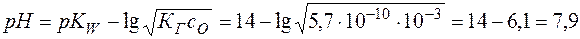 .
.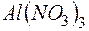 и
и 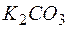 необратим и предложите продукты совместного гидролиза.
необратим и предложите продукты совместного гидролиза.


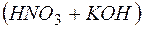 , которые вступают между собой в необратимую реакцию нейтрализации (в). Это обусловливает необратимость реакций (а) и (б). Суммирование левых и правых частей уравнений реакций (а), (б) и (в) приводит к стехиометрическому уравнению совместного гидролиза двух солей (г).
, которые вступают между собой в необратимую реакцию нейтрализации (в). Это обусловливает необратимость реакций (а) и (б). Суммирование левых и правых частей уравнений реакций (а), (б) и (в) приводит к стехиометрическому уравнению совместного гидролиза двух солей (г).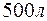 воды содержится
воды содержится 
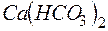 .
.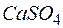 содержится в
содержится в  воды, если жесткость, обусловленная присутствием этой соли, равна
воды, если жесткость, обусловленная присутствием этой соли, равна  ?
? ?
?
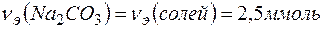
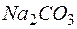 определяем по формуле:
определяем по формуле: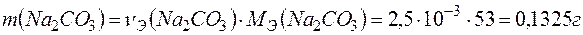
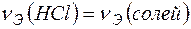 .
.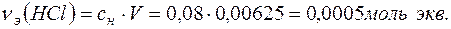
 , то
, то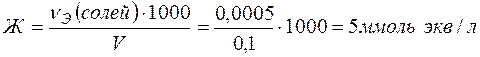 .
.



