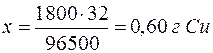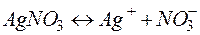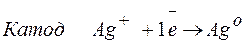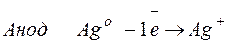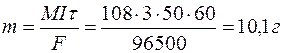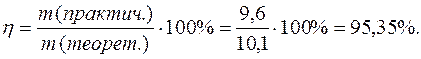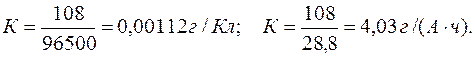Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Законы Фарадея. Выход продукта по токуСодержание книги
Поиск на нашем сайте
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде: 1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества; 2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов. Для расчетов используют математическое выражение обобщенного закона Фарадея:
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) превышает его количество, рассчитанное согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току:
Примеры решения типовых задач. Пример 1. Ряд активности металлов, электродных потенциалов. Задача 1. Медная пластинка массой 10 г была погружена в раствор нитрата серебра, затем промыта водой и высушена. Масса ее оказалась равной 11,0 г. Сколько серебра из раствора выделилось на пластинке? Решение. Для решения этой задачи необходимо знать стандартные электродные потенциалы металлов, т.е. место их в ряду напряжений (ряду активности металлов Бекетова).
Из этих положительных потенциалов стандартный электродный потенциал меди менее положителен, следовательно, пойдёт реакция вытеснения:
Для того чтобы вычислить количество серебра, выделившегося на медной пластинке, надо помнить, что медная пластинка в этой реакции и сама растворяется, теряя в массе. Обозначим количество растворившейся меди через x г, тогда масса медной пластинки с учётом её растворения будет (10-х) г, масса выделившегося серебра на основе реакции:
64,0 г Cu – 2 ∙ 108 г Ag х г Cu – (1+х) г Ag 216х =64+64х, 152x=64, x=0,42 г. Таким образом, в течение реакции растворилось 0,42 г меди и выделилось 1,0 + 0,42 = 1,42 г серебра.
Пример 2. Работа гальванического элемента и расчёт ЭДС. Задача 1. Напишите уравнения реакций, происходящих при работе гальванического элемента, состоящего из цинковой и серебряной пластин, опущенных в растворы своих солей с концентрацией катионов, равной 1 моль/л. Решение. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
Металл, имеющий более отрицательное значение электродного потенциала при работе гальваничеcкого элемента, является анодом. В данном случае протекают реакции:
т.е. цинк, являясь анодом, растворяется при работе гальваничеcкого элемента, а серебро осаждается в виде металла на катоде. ЭДС гальванического элемента равна
Пример 3. Зависимость электродных процессов от концентрации. Задача 1. Рассчитайте, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода равна 0,1 моль/л, а у катода – 0,001 моль/л. Решение. Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
Следовательно, анодом будет магниевый электрод, катодом – медный. Электродный потенциал металла, опущенного в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
где: с – концентрация катиона, моль/л; п – число электронов, принимающих участие в реакции. Отсюда потенциал магниевого электрода
Потенциал медного электрода
Тогда для гальванического элемента
Пример 4. Определение возможности протекания реакции в гальвани-ческом элементе. Задача 1. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса ΔGо298, укажите, можно ли в гальваническом элементе осуществить следующую реакцию: Fe0 + Cd2+= Fe2+ + Cd0. Решение. Надо составить схему гальванического элемента, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Fe 0 – 2е = Fe 2+ Cd 2+ + 2е = Cd 0. Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальваничекого элемента:
Изменение величины энергии Гиббса с величиной ЭДС связано соотношением:
где: n – число электронов, принимающих участие в реакции; F –число Фарадея;
Находим Так как Пример 5. Расчет количества вещества, выделившегося при электролизе. Задача 1. Какая масса меди осаждается на катоде при прохождении тока силой 2 А через раствор медного купороса в течение 15 минут? Решение. Сначала нужно узнать количество электричества, прошедшее через раствор, выразив его в кулонах (1Кл=А . с). Количество электричества Q=I
Пример 6. Определение электрохимического эквивалента и выхода по току. Задача 1. При электролизе водного раствора AgNO3 в течение 50 минут при силе тока 3А выделилось 9,6 г серебра. Электролиз проводился с растворимым анодом. Напишите уравнение реакций катодного и анодного процессов и определите электрохимический эквивалент серебра в г/Кл и г/А.ч и выход по току. Решение. Нитрат серебра диссоциирует:
Процессы, протекающие на электродах:
Молярная масса эквивалента AgО =108 г/моль. Определяем массу серебра, которая выделилась бы теоретически при прохождении через раствор данного количества электричества:
Выход по току
Электрохимический эквивалент
|
|||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 3814; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.45.11 (0.008 с.) |

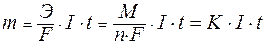 ,
,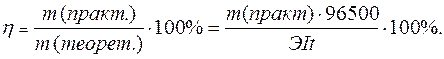
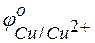 = +0.34 В;
= +0.34 В; 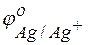 = +0.80 В.
= +0.80 В.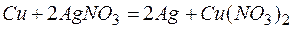
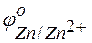 = –0,76 В;
= –0,76 В; 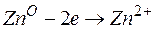
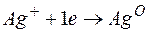
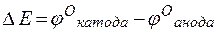 =
= 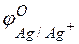 –
– 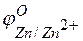 = +0,8 – (–0,76) =1,56 В.
= +0,8 – (–0,76) =1,56 В.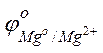 = –2,38 В;
= –2,38 В; 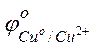 = +0.34 В.
= +0.34 В.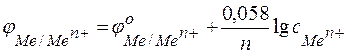 ,
,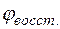 = –2,38 +
= –2,38 + 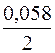 lg10–1 = –2,38 + 0,029(–1) = –2,409 В.
lg10–1 = –2,38 + 0,029(–1) = –2,409 В.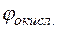 = +0,34 +
= +0,34 + 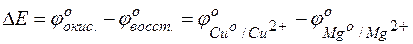 = +0,253–(–,409)=2,662В.
= +0,253–(–,409)=2,662В.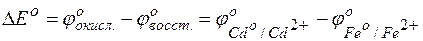 = –0,40– (–0,44)=0,04 В.
= –0,40– (–0,44)=0,04 В.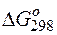 = – nF
= – nF 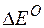 ,
,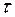 =2 . 15 . 60=1800 Кл. Молярная масса эквивалента меди (II) равна 64,0/2=32 г/моль. Следовательно:
=2 . 15 . 60=1800 Кл. Молярная масса эквивалента меди (II) равна 64,0/2=32 г/моль. Следовательно: