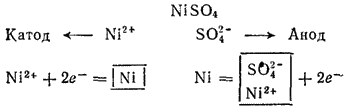Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Чтобы понять природу электрохимических процессов, обратимся к рассмотрению нескольких достаточно простых ситуаций. Представим себе металлическую пластинку, погруженную в воду. Под действием полярных молекул воды ионы металла отрываются от поверхности пластинки и гидратированными переходят в жидкую фазу. Последняя при этом заряжается положительно, а на металлической пластинке появляется избыток электронов. Чем дальше протекает процесс, тем больше становится заряд, как пластинки, так и жидкой фазы. Благодаря электростатическому притяжению катионов раствора и избыточных электронов металла на границе раздела фаз возникает так называемый двойной электрический слой, который тормозит дальнейший переход ионов металла в жидкую фазу. Наконец, наступает момент, когда между раствором и металлической пластинкой устанавливается равновесие, которое можно выразить уравнением:
или с учетом гидратации ионов в растворе:
Состояние этого равновесия зависит от природы металла, концентрации его ионов в растворе, от температуры и давления. При погружении металла не в воду, а в раствор соли этого металла равновесие в соответствии с принципом ЛеШателье смещается влево и тем больше, чем выше концентрация ионов металла в растворе. Активные металлы, ионы которых обладают хорошей способностью переходить в раствор, будут в этом случае заряжаться отрицательно, хотя в меньшей степени, чем в чистой воде. Равновесие можно сместить вправо, если тем или иным способом удалять электроны из металла. Это приведет к растворению металлической пластинки. Наоборот, если к металлической пластинке подводить электроны извне, то на ней будет происходить осаждение ионовиз раствора. При погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающую между металлом и окружающей его жидкой фазой, называют электродным потенциалом. Этот потенциал является характеристикой окислительно-восстановительной способности металла в виде твердой фазы. У изолированного металлического атома (состояние одноатомного пара, возникающее при высоких температурах и высоких степенях разрежения) окислительно-восстановительные свойства характеризуются другой величиной, называемой ионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома.
Абсолютное значение электродного потенциала нельзя измерить непосредственно. Вместе с тем не представляет труда измерение разности электродных потенциалов, которая возникает в системе, состоящей из двух пар металл - раствор. Такие пары называют полуэлементами. Условились определять электродные потенциалы металлов по отношению к так называемому стандартному водородному электроду, потенциал которого произвольно принят за ноль. Стандартный водородный электрод состоит из специально приготовленной платиновой пластинки, погруженной в раствор кислоты с концентрацией ионов водорода 1 моль/л и омываемой струёй газообразного водорода под давлением 105 Па, при температуре 25 °С. Ряд стандартных электродных потенциалов. Если пластинку металла, погруженную в раствор его соли с концентрацией ионов металла, равной 1 моль/л, соединить со стандартным водородным электродом, то получится гальванический элемент. Электродвижущая сила этого элемента (ЭДС), измеренная при 25 °С, и характеризует стандартный электродный потенциал металла, обозначаемый обычно как Е°. Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак “-”, а знак “+” имеют стандартные потенциалы электродов, являющихся окислителями. Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов: Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au. Ряд напряжений характеризует химические свойства металлов: 1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность. 2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в электрохимическом ряду напряжений металлов после него. 3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т. е. находящиеся в электрохимическом ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот. Как и в случае определения значения Е° металлов, значения Е° неметаллов измеряются при температуре 25 °С и при концентрации всех атомных и молекулярных частиц, участвующих в равновесии, равной 1 моль/л.
Алгебраическое значение стандартного окислительно-восстановительного потенциала характеризует окислительную активность соответствующей окисленной формы. Поэтому сопоставление значений стандартных окислительно-восстановительных потенциалов позволяет ответить на вопрос: протекает ли та или иная окислительно-восстановительная реакция? Количественным критерием оценки возможности протекания той или иной окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления. Контрольные вопросы 1. Для следующих реакций указать, какие вещества и за счет каких именно элементов играют роль окислителей и какие — восстановителей: а) S0 2 + Br2+ 2Н20 = 2НВг + H 2 S0 4 б) Mg + H2S04= MgS04+ Н2 в) Си + 2H2S04= CuS04+ S02+ 2Н20 г) 3I2+ 6КОН = КIO3+ 5KI+ 3Н20 2. Среди приведенных превращений указать реакции диспропорционирования: а) S + КОН→K 2 S0 3 + K2S + Н20 б) Аu2O3 → Au + O2 в) HC1 + Cr0 3 → CrCI 8 + Cl 2 + H20 г) НСЮз→C1О 2. + HC1О4 д) N 2 H 4 → N 2 + NH 3 е) AgN03 → Ag + NO2 + O2 3. Какие из следующих реакций относятся кокислительно-восстановительным? а) Н2 + Вr2 = 2НВr б) NH4С1 = NH3+ НСl в) NH4NO3→N2O+ 2Н20 г) 2К2СrO4 + H2S04= K2Cr207+ K2SO4+ Н2О д) Н 3 ВО 3 + 4HF= HBF 4 + 3Н2О е) Fe + S = FeS
Лекция № 11 Электрохимические процессы. Гальванический элемент. Электролиз. Цель: рассмотреть электролиз раславов, Электролиз. Электролизом называется совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита. Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав катионы магния под действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются
Анионы хлора перемещаются к положительному электроду и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия — окисление ионов хлора
а вторичным — связывание образующихся атомов хлора в молекулы:
Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава:
Эта реакция не может протекать самопроизвольно; энергия, необходимая для ее осуществления, поступает от внешнего источника тока. Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод - положительно, т. е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию.
При рассмотрении электролиза водных растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются еще ионы, являющиеся продуктами диссоциации воды — Аналогично у анода может происходить разряд как анионов электролита, так и гидроксид-ионов. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего будет зависеть от относительных значений электродных потенциалов соответствующих электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже. Рассматривая катодные процессы, протекающие при электролизе водных растворов, ограничимся важнейшим случаем— катодным восстановлением, приводящим к выделению элементов в свободном состоянии. Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода (см. стр. 273) и в случае нейтральных растворов
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды:
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеют При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину. На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фторо-водорода и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от
а в кислой или нейтральной:
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона
равен 2,01 В, что значительно превышает стандартный потенциал окисления воды (1,229 В). Стандартный потенциал окисления иона При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов
и
в ряду стандартных электродных потенциалов. Эта аномалия связана со значительным перенапряжением (см. § 104) второго и этих двух электродных процессов — материал анода оказывает тормозящее действие на процесс выделения кислорода. В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды с выделением кислорода, разряд аниона (т. е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Рассмотрим несколько типичных случаев электролиза водных растворов. Электролиз раствора Схема электролиза раствора хлорида
Электролиз раствора Схема электролиза раствора сульфата калия:
Рис. 86. Схема установки иллюстрмрующей, закон Фарадея. Электролиз раствора с никелевым анодом. Стандартный потенциал никеля В) несколько больше, чем —0,41 В; поэтому при электролизе нейтрального раствора на катоде в основном происходит разряд ионов и выделение металла. На аноде происходит противоположный процесс — окисление металла, так как потенциал никеля намного меньше потенциала окисления воды, а тем более — потенциала окисления иона. Таким образом, в данном случае электролиз сводится к растворению металла анода и выделению его на катоде. Схема электролиза раствора сульфата никеля:
Контрольные вопросы 1. Составить уравнения процессов протекающих при электролизе расплавов NaOHи NiCl2с инертными электродами. 2. Составить схемы электролиза водных растворов H2SO4, СuСl2, Pb(NO3)2с платиновыми электродами. 3. Написать - уравнения электродных процессов, протекающих при электролизе водных растворов ВаС12 и Pb(N03)2с угольными электродами. 4. Написать уравнения электродных процессов, протекающих при электролизе водных растворов FeCI3 и Са(N03)2 с инертным анодом. 5. Составить схемы электролиза водного раствора хлорида цинка; если: а) анод цинковый; б) анод угольный. 6. Составить схемы электролиза водного раствора сульфата меди, если: а) анод медный; б) анод угольный. 7. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации- сульфаты никеля, серебра, меди? 8. Раствор содержит ноны Fe2+, Ag+, Bi+в одинаковой концентрации; В какой последовательности эти ионы будут выделяться при электролизе, если напряжение достаточна для выделения любого металла?
Лекция № 12 Коррозия металлов, сплавов, бетонов. Способы защиты их от коррозии. План 1. Виды коррозий 2. Причины коррозии 3. Методы борьбы с коррозией КОРРОЗИЯ МЕТАЛЛОВ. Коррозией называется разрушение металла вследствие химического или электрохимического воздействия на него внешней среды. Коррозия – это неотвратимая потеря металлов, это большие убытки, поэтому борьба с коррозией – важнейшая задача для промышленности и вообще техники. Коррозия чёрных металлов называется ржавлением, ежегодно до 10 % выработанного железа расходуется на замену проржавевшего. В зависимости от воздействия среды различают атмосферную, жидкостную и газовую коррозию. По месту распределения коррозия бывает равномерная, местная и межкристаллитная. Теория коррозии Коррозия начинается с поверхности на границе двух фаз – «металл»-«внешняя среда» и с течением времени распространяется вглубь. По характеру физико-химических процессов, происходящих между металлом и внешней средой, различают два вида коррозии: химическую и электрохимическую. Химическую коррозия возникает в результате химического воздействия внешней среды на поверхность металла, например, образование слоя окислов (окалина) на металле в печах при высоких температурах, например, при отпуске. При разных температурах образуется на поверхности металла тонкая плёнка окисла, толщина которой увеличивается с ростом температуры. От толщины плёнки окисла и, значит, от ее оптических свойств зависит её цвет: при 220 оС – жёлтый, 255 оС – коричневый, 300 оС – тёмно-синий, 330 оС – серый, это так называемые «цвета побежалости», по ним определяют температуру отпуска. Электрохимическая коррозия – возникает при действии на металл электролитов. Это наиболее распространённый вид коррозии. Большинство металлических конструкций находится в соприкосновении с воздухом, водой и землёй – мосты, крыши зданий, механизмы (подъёмные краны), кабели, трубопроводы и так далее. В воздухе и земле всегда есть влага – роса, дождь, водяные пары, грунтовые воды и так далее. На конструкциях всегда есть грязь, в воздухе – SO2, SO3, NO2, NO3, СО, которые растворяясь в воде, диссоциируют на положительные и отрицательные ионы – а это электролит, который и вызывает электрохимическую коррозию (ЭХК). Коррозия металлов и сплавов в электролите аналогична работе гальванического элемента. Металлы и сплавы по химическому составу неоднородны и различаются также по структуре составляющих их частей: твёрдый раствор, химическое соединение, механическая смесь. Эти структурные составляющие имеют различные электродные потенциалы, обусловленные их химической и физической природой. Когда сплав находится в электролите, одни участки, имеющие низкий электродный потенциал, становятся анодами (что значит «подъём») и разрушаются, так как их ионы переходят в раствор электролита и становятся солями при высыхании воды. Другие участки, обладающие более высоким электродным потенциалом, становятся – катодами (это значит «путь вниз») и сохраняются неизменными, так как на них ионы Н+ нейтрализуются и образуется Н2. Так как анодных и катодных участков в сплаве очень много, то сплав можно рассматривать состоящим из большого числа электродов, то есть как многоэлектродный микроэлемент. Когда два микроэлемента находятся в контакте (болтовое соединение (например, чугунный фланец и стальной болт), склёпанные листы и др.), то образуется макроэлемент. Методы защиты от коррозии 1. Защита легированием – при легировании стали хромом или хромом и никелем (более эффективно) сталь способна сопротивляться коррозии, так как её электродный потенциал становится высоким и она является отрицательно заряженным катодом. Дорогостоящий никель частично заменяют более дешевым марганцем. Хрома должно быть не менее 12 %, иначе сталь становится паложительно заряженным анодом (на нержавеющей посуде стоит знак «18/10», это значит, в металле 10 % Ni и 18 % Cr). 2. Защита неметаллическими плёнками. Это окисные плёнки, получаемые оксидированием и фосфатные плёнки, получаемые фосфатированием. Детали обрабатывают либо сильным окислителем (едким натром NаОН), либо смесями фосфорной кислоты и её солей, в результате детали покрываются окисной плёнкой чёрно-синего цвета (воронение), либо фосфатной плёнкой. 3. Защита металлическими покрытиями. На поверхность детали наносится тонкий слой другого металла, в зависимости от того, какой металл наносится, процесс называется: – Zn – цинкование, Al – алитирование, Sn – лужение, Pb – свинцевание, Cr – хромирование, Cd – кадмирование, Ni – никелирование, Cu – меднение, также покрывают металл латунью и бронзой. Способы нанесения металла на деталь: 1. погружением детали в расплавленный металл, применяется для нанесения пленок из плавящихся при низких температурах металлов (цинка, олова, свинца) – используется в случае деталей небольшого размера; 2. путём распыления расплавленного металла (цинка, кадмия) сжатым воздухом с набрызгиванием его на деталь – для крупных деталей; 3. диффузионным методом – алитирование, хромирование (см. выше, ХТО). 4. гальваническим путём – электролиз водных растворов солей того металла, который является покрытием. Преимущества метода: управляемость процессом, экономное расходование металла, отсутствие нагрева. Различают анодное и катодное покрытие. – анодное (цинком) – у цинка электродный потенциал ниже, чем у железа, поэтому он защищает и механически, и электрохимически, так как он является анодом (+) и разрушается; – катодное (оловом) – электродный потенциал олова выше, чем у железа, то защищает только механически, а в случае повреждения плёнки электрохимическим путём разрушается железо. 5. методом плакирования – термин происходит от французского слова «плаке», что значит накладывать, покрывать – горячей прокаткой или прессованием покрывают один металл тонким слоем другого металла – например, сталь латунью, дюралюмин – алюминием. 4. Защита протекторами – от латинского защищающий – к детали, находящейся в электролите (в почве всегда есть вода) присоединяют металл с меньшим электродным потенциалом (обычно цинк), который, являясь анодом, и разрушается. Деталь является катодом и не корродирует. 5. Защита неметаллическими покрытиями. Это краски, лаки – они дешёвы, экономят цветные металлы, защищают любые конструкции. Недостаток – трескаются и пропускают воду. Применяются краски масляные и эмалевые. 6. Защита обработкой коррозионной среды. Есть вещества, замедляющие химические реакции и даже прекращающие их (их называют ингибиторами). Когда такой ингибитор вводят в коррозионную среду (например, в воду радиаторов двигателей внутреннего сгорания, теплообменников, компрессоров), то коррозия практически прекращается. Достоинство – ингибитора требуется обычно мало, так как он, сдерживая реакцию, сам в ней не участвует (как и катализатор, который ускоряет химическую реакцию, также не участвуя в ней). Контрольные вопросы 1. Какие виды коррозии существуют? 2. Перечислите основные причины коррозии. 3. Расскажите о коррозии бетонов. 4. Какие виды защиты металлов от коррозии существуют? 5. Какие виды защиты бетонов от коррозии существуют? 6. Что значит протекторная защита?
Лекция №13 Комплексные соединения. Теория кристаллического поля План 1. Координационная теория 2. Номенклатура комплексных соединений 3. Методы установления координационный формул. 4. Теория кристаллического поля. 5. Устойчивость координационныхсоеинений. Координационная теория В молекуле комплексного соединения различают следующие структурные элементы: ион-комплексообразователь, координированные вокруг него присоединенные частицы - лиганды, составляющие вместе с комплексообразователем внутреннюю координационную сферу, и остальные частицы входящие во внешнюю координационную сферу. При растворении комплексных соединений лиганды остаются в прочной связи с ионом-комплексообразователем, образуя почти недиссоциирующий комплексный ион. Число лигандов называется координационным числом (к.ч.). Рассмотрим ферроцианид калия K4[Fe(CN)6] – комплексное соединение, образующееся при взаимодействии 4KCN+Fe(CN)2=K4[Fe(CN)6]. При растворении комплексное соединение диссоциирует на ионы: K4[Fe(CN)6]↔4K++[Fe(CN)6]4- Характерные комплексообразователи: Fe2+, Fe3+, Co3+, Cr3+, Ag+, Zn2+, Ni2+. Характерные лиганды: Cl-, Br-, NO2-, CN-, NH3, H2O. Заряд комплексообразователя равняется алгебраической сумме зарядов составляющих его ионов, например, [Fex(CN)6]4-, x+6(-1)=-4, x=2. Входящие в состав комплексного иона нейтральные молекулы оказывают влияния на заряд. Если вся внутренняя сфера заполнена только нейтральными молекулами, то заряд иона равен заряду комплексообразователя. Так, у иона [Cux(NH3)4]2+, заряд меди x=+2. Заряд комплексного иона равен сумме зарядов ионов, находящихся во внешней сфере. В K4[Fe(CN)6] заряд [Fe(CN)6] равен -4, так как во внешней сфере находится 4K+, а молекула в целом электронейтральна. Возможно взаимное замещение лигандов во внутренней сфере при сохранении одного и того же координационного числа, например, [Co(NH3)5NO2]Cl2, [Co(NH3)4(NO2)2]Cl, [CoCl (NH3)3(NO2)2]. Заряд иона кобальта равен +3.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 459; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.47.157 (0.018 с.) |

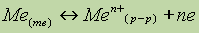
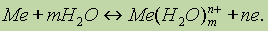
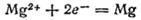
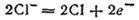
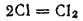
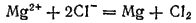
 и
и  . В электрическом поле ионы водорода перемещаются к катоду, а ионы
. В электрическом поле ионы водорода перемещаются к катоду, а ионы 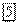 — к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода.
— к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. имеет значение
имеет значение 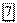 В. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно поло-жительнее, чем —0,41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем —0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений — приблизительно до титана. Наконец, если потенциал металла близок к значению —0,41 В (металлы средней части ряда —
В. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно поло-жительнее, чем —0,41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем —0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений — приблизительно до титана. Наконец, если потенциал металла близок к значению —0,41 В (металлы средней части ряда — 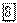 ), то в зависимости от концентрации раствора и условий электролиза
), то в зависимости от концентрации раствора и условий электролиза  возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода.
возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода.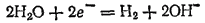
 раствора, концентрация ионов металла и другие условия электролиза.
раствора, концентрация ионов металла и другие условия электролиза. раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид
раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид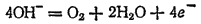
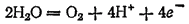

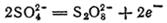
 имеет еще большее значение (2,866 В).
имеет еще большее значение (2,866 В). и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе
и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе 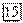 и ее солей противоречит взаимному положению систем
и ее солей противоречит взаимному положению систем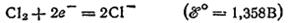

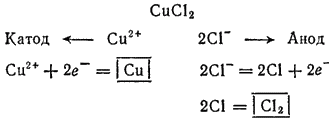
 с инертным анодом. Медь в ряду напряжений расположена после водорода: поэтому у катода будет происходить разряд ионов
с инертным анодом. Медь в ряду напряжений расположена после водорода: поэтому у катода будет происходить разряд ионов  и выделение металлической меди. У анода будут разряжаться хлорид-ионы.
и выделение металлической меди. У анода будут разряжаться хлорид-ионы. :
:
 с инертным анодом. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионов
с инертным анодом. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионов  . У анода будет идти выделение кислорода и накопление ионов
. У анода будет идти выделение кислорода и накопление ионов  . В то же время в катодное пространство будут приходить ионы
. В то же время в катодное пространство будут приходить ионы  , а в анодное —
, а в анодное —  . Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном — кислота.
. Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном — кислота.