Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биохимия . Предмет, цели и задачи . Биохимические методы анализаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Биохимия. Предмет, цели и задачи. Биохимические методы анализа 1. Биологическая химия (биохимия) — наука о химическом составе и свойствах веществ живых организмов, о превращениях веществ в процессе жизнедеятельности. Совокупность этих превращений, отражающих постоянную взаимосвязь организма с внешней средой, принято называть обменом веществ. Значение биохимии как науки для человеческого общества определяется тем, что она является одной из теоретических основ медицины, сельского хозяйства, биотехнологии, генетической инженерии и ряда отраслей промышленности, лесного дела. Биохимию принято делить на статическую и динамическую.Задачастатической биохимии — изучение химического состава и свойств веществ живых организмов. Динамическая биохимия изучает превращения веществ в процессе жизнедеятельности или течение химических процессов в живой материи. Методы биохимии. Метод синтеза - способ соединения аминокислот друг с другом (пептидные связи) в молекулах белка и затем выяснить последовательность расположения аминокислотных остатков в полипептидных цепях белковых молекул. Методу радиоактивных изотопов -дает возможность проследить за перемещением того или иного вещества в организме. С помощью электронного микроокопа при очень сильном увеличении удалось изучить строение клеток, выявить в них наличие субклеточных образований физические методы - метод рентгеноструктурного анализа, при помощи которого выявлена структура сложных соединений Физико-химические методы п озволили выяснить основные принципы построения биополимеров - белков, нуклеиновых кислот и полисахаридов, а познание молекулярного строения живого позволяет глубоко проникнуть в тайны жизненных процессов. Строение и физико-химические свойства природных аминокислот. Строение и свойства аминокислот 1. Общие структурные особенности Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же?-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
В водных растворах при нейтральном значении рН - аминокислоты существуют в виде биполярных ионов. В отличие от 19 остальных?-аминокислот, пролин - аминокислота, радикал которой связан как с?-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
Из 20 аминокислот содержат в?-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного?-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментатив-но превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к?-углеродному атому. По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические. Алифатические аминокислоты. Они составляют наиболее многочисленную группу. В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют
В алифатическом радикале могут содержаться дополнительные функциональные группы: Ароматические и гетероциклические аминокислоты. Эти аминокислоты построены таким образом, что бензольные и гетероциклические кольца в них отделены от общего аминокислотного фрагмента метиленовой группой —СН2—. Стереоизомерия. Принцип построения аминокислот, т. е. нахождение у одного и того же атома углерода двух различных функциональных групп, радикала и атома водорода, уже сам по себе предопределяет хиральность альфа-атома углерода. Исключение составляет простейшая аминокислота глицин Н2N-СН2-СООН, не имеющая углеводородного радикала R и соответственно центра хиральности. Большинство аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные аминокислоты принадлежат к L-ряду.
Изолейцин, треонин, 4—гидроксипролин — содержат в молекуле по два центра хиральности. Эти аминокислоты могут существовать в виде четырех диастереомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Из этих четырех стереоизомеров для построения белков человеческого организма используется только один. В твердом состоянии аминокислоты существуют в виде биполярных ионов; в водном растворе — в виде равновесной смеси биполярного иона, катионной и анионной форм. Положение равновесия зависит от рН среды. Общим для всех аминокислот является преобладание катионных форм в сильнокислых (pH 1—2) и анионных — в сильнощелочных (рH 13— 14) средах.
Ионное строение обусловливает некоторые особенности аминокислот: высокую температуру плавления (выше 200С), нелетучесть, растворимость в воде и нерастворимость в неполярных органических растворителях. Полностью протонированная аминокислота (катионная форма) с позиций теории Брёнстеда является двухосновной кислотой, содержащей две кислотные группы: недиссоциированную карбоксильную группу и протонированную аминогруппу, характеризующиеся соответствующими значениями рКа. Отдавая один протон, такая двухосновная кислота превращается в слабую одноосновную кислоту — биполярный нон с одной кислотной NН3-грулпой. Депротонирование биполярного нона приводит к получению анионной формы аминокислоты — ацилат-иону, являющемуся основанием Брёнстеда. 4) Классификации аминокислот. Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде: По функциональным группам Алифатические Иминокислоты: пролин По способности организма синтезировать из предшественников. 1)Незаменимые:Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин. 2)Заменимые:Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
5) Физико-химические свойства белка. Обратимое и необратимое осаждение белка. Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм (это свойство, обусловленное наличием в белках ароматических аминокислот, используется для количественного определения белков). Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых и основных аминокислот белки в растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду или катоду. Это свойство используется при очистке белков методом электрофореза. Белки обладают явно выраженными гидрофильными свойствами. Растворы белков имеют очень низкое осмотическое давление, высокую вязкость и незначительную способность к диффузии. Белки способны к набуханию в очень больших пределах. С коллоидным состоянием белков связан ряд характерных свойств, в частности явление светорассеяния, лежащее в основе количественного определения белков методом нефелометрии. Этот эффект используется, кроме того, в современных методах микроскопии биологических объектов. Реакции осаждения белков. Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции.Обратимое осаждение. Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание. Высаливание. Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором - глобулиновая фракция. Сущность реакции заключается в дегидратации молекул белка. Реактивы: 1) неразведенный яичный белок; 2) насыщенный раствор сульфата аммония; 3) NaOH, 10% раствор, 4) CuSO4, 1% раствор; 5) дистиллированная вода; 6) сульфат аммония в порошке. Ход определения. В пробирку наливают 30 капель неразведенного яичного белка и добавляют равное количество насыщенного раствора сульфата аммония. Содержимое пробирки перемешивают. Получают полунасыщенный раствор сульфата аммония, при этом глобулиновая фракция осаждается, а альбуминовая остается в растворе. Последнюю отфильтровывают, затем смешивают с порошком сульфата аммония до тех пор пока не прекратится растворение соли, при этом выпадает осадок - глобулины. Необратимое осаждение белков. Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов. 6) Этапы денатурации и ренатурации белков. Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов(температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи и т.д). При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка. При денатурации происходит разрыв нековалентных (в первую очередь водородных) связей в молекуле белка, что сопровождается нарушением четвертичной, третичной и частично вторичной структур белка без каких-либо изменений первичной структуры. Разрыв нековалентных связей приводит к тому, что компактная молекула белка превращается в беспорядочный клубок.
Функции белков. Структурная (пластическая, опорная) – определяет структуру тела человека, растений, животных, вирусов, микроорганизмов, входят в состав различных биологических мембран. Имеется целая группа белков, для которых эта функция является основной – коллагены, эластины, кератины. 2) Каталитическая – белки обладают свойствами биокатализаторов (ферментов), ускоряя течение биологических процессов в организме. 3) Энергетическая – за счет части аминокислот. На долю белка приходится 10-20% энергопотребления у человека. Регуляторная – белки играют важную роль в обменных процессах, осуществляют связь внутренней среды организма с внешней средой. Это гормоны, ферменты, БАВ, пептиды и т.д.). Рецепторы, через которые осуществляются регуляторные процессы также являются белками. Классификация белков. По химическому составу белки делятся на 2 класса – простые (при гидролизе распадаются только на аминокислоты), сложные (при гидролизе дают не только аминокислоты, но и другие структуры – простетические группы). Простые белки по растворимости и пространственному строению разделяют на глобулярные и фибриллярные. Глобулярные имеют шарообразную форму молекулы, растворимы в воде и солевых растворах. К этой группе относятся все ферменты и большинство других БАБ, исключая структурные. Среди глобулярных белков можно выделить альбумины, глобулины, протамины и гистоны. Фибриллярные белки характеризуются волокнистой структурой, делятся на растворимые и нерастворимые. К первой подгруппе относятся миозин, актин, фибриноген, ко второй – склеропротеины (протеноиды – кератины, эластины, коллагены). Сложные белки – НП, МП, ГП, ФП, ХП, ЛП. Такое деление белков условно, поскольку многие простые белки также содержат небелковый компонент. Представители Роль гемоглобина. Гемоглобин – основной белок эритроцитов. В 1-ом эритроците содержится 340 млн молекул гемоглобина, каждая из которых состоит из 103 атомов С, Н, О, N, S и 4 атомов железа. Основная роль – перенос кислорода от легких к тканям (оксигенация – показать на доске) и углекислого газа от тканей к легким. Гемоглобин образует буферные системы, которые участвуют в поддержании КОС. При распаде гемоглобина образуются пигменты кала, мочи и желчи. Гемоглобин участвует в обезвреживании оксида азота, который может присоединяться к нему и образовывать нитрозгемоглобин. Молекула миоглобина состоит из 1-го гема и 1-ой п/п цепи (из 153 аминокислот). Гем миоглобина такой же как у гемоглобина. Роль миоглобина – транспорт кислорода от оксигемоглобина к ферментам дыхательной цепи в клетке – показать на доске реакцию. Содержится, в основном, в цитоплазме мышечных клеток. Также служит в качестве депо кислорода. Миоглобина больше в натренированных мышцах – у диких животных, особенно у ныряющих – кашалота, тюленей (например, у зайца больше, чем у кролика). Миоглобин специфический белок мышц, поэтому его появление вы сыворотке крови говорит о поражении мышечной ткани (заболевания мышц, инфаркт миокарда). Ферменты, как и небиологические катализаторы, катализируют только те реакции, которые подчиняются II закону термодинамики и являются энергетически возможными. Фермен ты не входят в состав конечных продуктов реакции, не влияют на константу равновесия ре акции, а только увеличивают скорость ее достижения. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа Установлено, что у сложных ферментов в состав активного центра входят также просте-тические группы. В активном центре условно различают так называемый каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, или контактную («якорную») площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. В связи с введением Международной системы единиц (СИ) предложено новое выражение активности фермента в каталах (кат, kat): 1 кат есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с (1 моль/с). Отношение международной единицы (U) к каталу можно выразить следующим образом: 1 кат = 1 моль•с–1 = 60 моль•мин–1 = 60•106 мкмоль•мин–1 = 6•107 U, или: 1 U = 1 мкмоль•мин–1 = (1/60) мкмоль•с–1 = (1/60) мккат = 16,67 нкат. Таким образом, 1 U фермента соответствует 16,67 нкат. 27.Механизм действия ферментов. Значение образования фермент субстратного комплекса в процессе катализа. В этом вопросе читайте всё!!!! Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные свойства, связанные с особенностями строения ферментов. Сходство ферментов с небиологическими катализаторами заключается в том, что: ферменты катализируют энергетически возможные реакции; энергия химической системы остаётся постоянной; в ходе катализа направление реакции не изменяется; Где
Константа Михаэлиса, Км - кинетический параметр ферментативной реакции, численно равный От конц. Субстата Скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени: V= D[S]/t = D[P]/t. От температуры среды Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы (рис. 2-17).
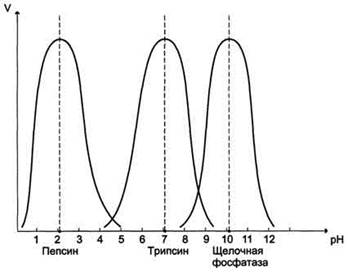
Рис. 2-17. Зависимость скорости ферментативной реакции (V) от температуры От pH среды Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Оптимум значения рН у разных ферментов различный (рис. 2-18). Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН.
Рис. 2-18. Зависимость скорости ферментативной реакции (V) от рН среды. Ферменты теряют каталитическую активность при воздействии различных факторов, вызывающих денатурацию (нагревание, кислоты, щелочи, соли тяжелых металлов и др.). Подобное разрушение фермента не рассматривается как ингибирование, так как оно не связано с механизмом действия фермента. Ингибиторы действуют на скорость реакции определенным химическим путем. Различают обратимое и необратимое ингибирование фермента. При обратимом ингибировании активность фермента восстанавливается по мере удаления свободного ингибитора диализом или иным способом, т.е. при обратимом ингибировании существует равновесие между свободным ингибитором и ферментом. При необратимом ингибировании равновесие между свободным ингибитором и ферментом не устанавливается и активность фермента не удается восстановить диализом. Напротив, если ингибитор присутствует в избытке по сравнению с ферментом, то со временем наступает полное торможение активности фермента. Неконкурентное ингибирование вызывают вещества, не имеющие структурного сходства с субстратом. Причем эти вещества обратимо присоединяются к ферменту не в активном центре, где обычно связывается субстрат, а совсем в другом месте и, следовательно, конкуренция между субстратом и ингибитором отсутствует. Связываясь с ферментом, неконкурентные ингибиторы вызывают изменение пространственной структуры активного центра, и, хотя присоединение субстрата к такому активному центру происходит, тем не менее катализ становится невозможным. Неконкурентные ингибиторы связываются обратимо как со свободным ферментом, так и с фермент-субстратным комплексом, образуя неактивные фермент-ингибитор (ЕJ) и (или) фермент-субстрат-ингибитор (ESJ). Наряду с инигибиторами существует целый ряд активаторов ферментов. А к т и в а т о р а м и называют вещества, увеличивающие каталитическую активность ферментов. Среди активаторов встречаются самые разнообразные вещества. Особенно часто роль активаторов ферментов выполняют ионы металлов: калия, кальция, магния, цинка, меди, железа, марганца, кобальта, а из анионов - хлора. Для проявления максимальной активности ферментов требуется определнная концентрация ионов-активаторов в среде. Изоферменты-это ферменты, катализирующие идентичные реакции, но отличающиеся друг от друга строением и каталитическими свойствами. К изоферментам относят только те формы ферментов, появление которых связано с генетически детерминированными различиями в первичной структуре пептидной цепи. Множественные формы ферментов можно разделить на две категории: Изоферменты Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, хотя и катализируют одну и ту же реакцию. Свойства ферментов: Ферменты характеризуются следующими основными свойствами. Поскольку практически все реакции в клетке катализируются ферментами, регуляция метаболизма сводится к регуляции интенсивности ферментативных реакций. Скорость последних может регулироваться двумя основными способами: путем изменения количества ферментов и/или изменения их активности, т. с. степени использования их каталитического потенциала. Факторы, регулирующие активность ферментов, разнообразны по своей природе. Физические факторы (температура, давление, свет, магнитное поле, электрические импульсы оказывают менее специфическое действие, чем химические. ТИПА. Гормоны - это то, что делает нас особенным и непохожим на остальных. Они предопределяют наши физические и психические особенности. Вырастем мы высоким или не очень, полным или худым. Наши гормоны влияют на все аспекты нашей жизни - с момента зачатия и до самой смерти. Они будут влиять на наш рост, половое развитие, формирование наших желаний, на обмен веществ в организме, на крепость мышц, на остроту ума, поведение, даже на наш сон. Гормоны – химические соединения, обладающие высокой биологической активностью и в малых количествах значительным физиологическим эффектом. Гормоны транспортируются кровью к органам и тканям, при этом лишь небольшая их часть циркулирует в свободном активном виде. Основная часть находится в крови в связанной форме в виде обратимых комплексов с белками плазмы крови и форменными элементами. Эти две формы находятся в равновесии друг с другом, причем равновесие в состоянии покоя значительно сдвинуто в сторону обратимых комплексов. Их концентрация составляет 80 %, а иногда и более от суммарной концентрации данного гормона в крови. По химической природе Для всех гормонов характерен относительно небольшой период полужизни – около 30 мин. Гормоны должны постоянно синтезироваться и секретироваться, действовать быстро и с большой скоростью инактивироваться. Только в этом случае они могут эффективно работать в качестве регуляторов. Высокую биологическая активность (гормоны вырабатываются железами в малых количествах, эффективны в очень небольших концентрациях, небольшая часть гормонов циркулирует в крови в свободном активном состоянии). Гормоны функционируют как химические посредники, переносящие информацию или сигнал в определенное место – клетку-мишень, которая имеет высокоспециализированный белковый рецептор, с которым связывается гормон. Организма.
44. Холестерин и его производные: строение, свойства и функции. ХОЛЕСТЕРИН- органическое соединение, природный жирный (липофильный) спирт, содержащийся в клеточных мембранах всех живых организмов за исключением безъядерных (прокариоты). Нерастворим в воде, растворим в жирах и органических растворителях. Около 80 % холестерина вырабатывается самим организмом (печенью, кишечником, почками, надпочечниками, половыми железами), остальные 20 % поступают с пищей[1]. В организме находится 80 % свободного и 20 % связанного холестерина. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. СИНТЕЗ: Холестерин может образовываться в животном организме и поступать в него с пищей. В настоящее время установлена следующая цепь биосинтеза холестерина (основа биосинтеза и других стероидов), включающая в себя несколько ступеней. -Превращение трёх молекул активного ацетата в пятиуглеродный мевалонат. Происходит в ГЭПР. -Превращение мевалоната в активный изопреноид — изопентенилпирофосфат. -Образование тридцатиуглеродного изопреноида сквалена из шести молекул изопентенилдифосфата. -Циклизация сквалена в ланостерин. -Последующее превращение ланостерина в холестерин. Функции. 1) структурный компонент клеточных мембран, 2) образует в организме человека желчные кислоты, витамин Д3, выработка надпочечниками различных стероидных гормонов, включая кортизол, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормона тестостерона 3) играет важную роль в деятельности синапсов головного мозга и иммунной системы, включая защиту от рака. Свойства: -не растворим в воде -растворим в спиртах и других органических растворителях, а так же в растительных и животных жирах. - способен образовывать сложные эфиры при реакции с жирными кислотами
45. Жирные кислоты: строение, свойства и функции.
ЖИРНЫЕ КИСЛОТЫ - большая группа органических соединений, представляющих собой алифатические карбоновые кислоты, многие из которых входят в состав липидов животных и растений.
ФУНКЦИИ: -энергетическая -пластическая -строение биологических мембран - способствуют синтезу простагландинов, которые наделены достаточно сильным противовоспалительным эффектом -расширяют кровеносные сосуды, снижают риск развития тромбов в кровеносных сосудах, питают сердечную мышцу, а также препятствовуют возникновению атеросклероза..
46. Простагландины, их биологическая роль.
ПРОСТАГЛАНДИНЫ, биологически активные вещества, обнаруженные в тканях и органах большинства животных и человека, в нек-рых растениях. По химич. природе — жирные кислоты, имеющие скелет из 20 атомов углерода и содержащие циклопентановое кольцо. Важнейшее физиол. действие— способность вызывать сокращение гладких мышц, особенно мышц матки и яйцеводов, а также мышц пищеварит. и дыхат. систем, кровеносных сосудов. Кроме того, снижают способность тромбоцитов к агрегации, выделение желудочного сока и его кислотность, оказывают противозачаточный эффекты. П. действуют, в отличие от классич. гормонов, вблизи места секреции. Высокая и разнообразная физиол. активность П. осуществляется посредством регуляции синтеза цАМФ (цГМФ), к-рый влияет на синтез белков, П. участвуют в регуляции клеточного ответа на нейрогуморальные воздействия. Связь П. с циклич. нуклеотидами и гормонами указывает на принципиальную возможность посредством П. воздействовать на разл. процессы в организме. П. применяются в медицине.
Стероидные гормоны синтезируются из холестерина, в основном, в коре надпочечников, тестикулах, яичниках и плаценте; однако, каждая ткань, продуцирующая стероиды, имеет свой собственный характерный профиль продуктов секреции. Структурно стероиды отличаются друг от друга количеством и расположением функциональных групп, степенью насыщенности углеводных связей, длиной боковой цепи, прикрепленной к стероидному ядру, и другими химическими характеристиками. II. Образование комплекса СР Все Р стероидных гормонов представляют собой глобулярные белки примерно одинакового размера, с очень высоким сродством связывающие гормоны Трансформация СР в форму, способную связываться ядерными акцепторами [СР] Любая клетка содержит всю генетическую информацию. Однако при специализации клетки большая часть ДНК лишается возможности быть матрицей для синтеза иРНК. Это достигается путем сворачивания вокруг белков гистонов, что ведет к препятствию транскрипции. В связи с этим генетический материал клетки можно разделить на ДНК 3-х видов: Транскрипционно неактивная Постоянно экспрессируемая Биологически активные вещества, вырабатываемые в половых железах, коре надпочечников и плаценте, стимулирующие и регулирующие половую дифференцировку в раннем эмбриональном периоде, развитие первичных и вторичных половых признаков, функционирование половых органов и формирование специфических поведенческих реакций, а также влияющие на обмен веществ, состояние систем адаптации организма и др. По биологическому действию делятся на андрогены, эстрогены и гестагены - гормоны жёлтого тела. Витамин D регулирует также усвоение фосфора, уровень содержания кальция и фосфора в крови и поступление их в костную ткань и зубы. Вместе с витамином A и кальцием или фосфором защищает организм от простуды, гриппа, диабета, глазных и кожных заболеваний. Он также способствует предотвращению зубного кариеса и патологий дёсен, помогает бороться с остеопорозом и ускоряет заживление переломов. Источники: Жирная рыба
Функции: Витамин А участвует в окислительно-восстановительных процессах, регуляции синтеза белков, способствует нормальному обмену веществ, функции клеточных и субклеточных мембран, играет важную роль в формировании костей и зубов, а также жировых отложений; необходим для роста новых клеток, замедляет процесс старения. 2)Витамин А поддерживает ночное зрение путём образования пигмента, называемого родопсин, способного улавливать минимальный свет, что очень важно для ночного зрения. Он также способствует увлажнению глаз, особенно уголков, предохраняя их от пересыхания и последующего травмирования роговицы. Лучшие источники витамина А— рыбий жир и печень, следующими в ряду стоят сливочное масло, яичный желток, сливки и цельное молоко. Зерновые продукты и снятое молоко, даже с добавками витамина, являются неудовлетворительными источниками, равно как и говядина, где витамин А содержится в ничтожных количествах. Рекомендуемой суточной дозой витамина А является: Мкг для мужчин Мкг для женщин Источники Пантотеновой кислоты.Суточная потребность в витамине В5 для взрослого в среднем составляет 5 мг. Основными его источниками для человека являются печень, дрожжи, яичный желток и зеленые части растений. Пантотеновая кислота, кроме того, синтезируется микрофлорой кишечника. <
|
|||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 2539; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.014 с.) |

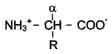





 Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы. Все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой. Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0).
Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы. Все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой. Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). 
 Различают 2 вида денатурации:1)Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности. 2)необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Различают 2 вида денатурации:1)Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности. 2)необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.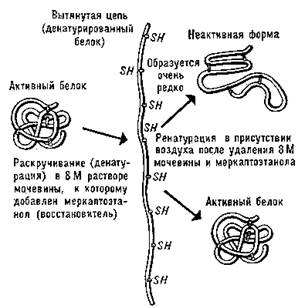
 — максимальная скорость реакции, равная
— максимальная скорость реакции, равная  ;
; — константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной;
— константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной; — концентрация субстрата.
— концентрация субстрата.