Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцинСодержание книги
Поиск на нашем сайте
Оксимоноаминокарбоновые: серин, треонин Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд Амиды моноаминодикарбоновых: аспарагин, глутамин Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд Серосодержащие: цистеин, метионин Ароматические: фенилаланин, тирозин, триптофан, (гистидин) Гетероциклические: триптофан, гистидин, пролин Иминокислоты: пролин По способности организма синтезировать из предшественников. 1)Незаменимые:Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин. 2)Заменимые:Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
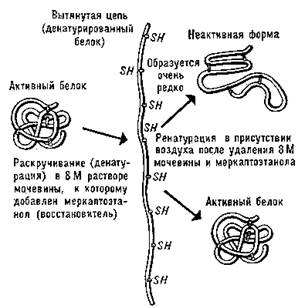
5) Физико-химические свойства белка. Обратимое и необратимое осаждение белка. Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм (это свойство, обусловленное наличием в белках ароматических аминокислот, используется для количественного определения белков). Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых и основных аминокислот белки в растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду или катоду. Это свойство используется при очистке белков методом электрофореза. Белки обладают явно выраженными гидрофильными свойствами. Растворы белков имеют очень низкое осмотическое давление, высокую вязкость и незначительную способность к диффузии. Белки способны к набуханию в очень больших пределах. С коллоидным состоянием белков связан ряд характерных свойств, в частности явление светорассеяния, лежащее в основе количественного определения белков методом нефелометрии. Этот эффект используется, кроме того, в современных методах микроскопии биологических объектов. Реакции осаждения белков. Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции.Обратимое осаждение. Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание. Высаливание. Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором - глобулиновая фракция. Сущность реакции заключается в дегидратации молекул белка. Реактивы: 1) неразведенный яичный белок; 2) насыщенный раствор сульфата аммония; 3) NaOH, 10% раствор, 4) CuSO4, 1% раствор; 5) дистиллированная вода; 6) сульфат аммония в порошке. Ход определения. В пробирку наливают 30 капель неразведенного яичного белка и добавляют равное количество насыщенного раствора сульфата аммония. Содержимое пробирки перемешивают. Получают полунасыщенный раствор сульфата аммония, при этом глобулиновая фракция осаждается, а альбуминовая остается в растворе. Последнюю отфильтровывают, затем смешивают с порошком сульфата аммония до тех пор пока не прекратится растворение соли, при этом выпадает осадок - глобулины. Необратимое осаждение белков. Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов. 6) Этапы денатурации и ренатурации белков. Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов(температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи и т.д). При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка. При денатурации происходит разрыв нековалентных (в первую очередь водородных) связей в молекуле белка, что сопровождается нарушением четвертичной, третичной и частично вторичной структур белка без каких-либо изменений первичной структуры. Разрыв нековалентных связей приводит к тому, что компактная молекула белка превращается в беспорядочный клубок.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 779; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.253.198 (0.007 с.) |

 Различают 2 вида денатурации:1)Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности. 2)необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Различают 2 вида денатурации:1)Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности. 2)необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.