
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение и физико-химические свойства природных аминокислот.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Строение и свойства аминокислот 1. Общие структурные особенности Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же?-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
В водных растворах при нейтральном значении рН - аминокислоты существуют в виде биполярных ионов. В отличие от 19 остальных?-аминокислот, пролин - аминокислота, радикал которой связан как с?-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
Из 20 аминокислот содержат в?-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного?-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментатив-но превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к?-углеродному атому. По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические. Алифатические аминокислоты. Они составляют наиболее многочисленную группу. В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют
В алифатическом радикале могут содержаться дополнительные функциональные группы: Ароматические и гетероциклические аминокислоты. Эти аминокислоты построены таким образом, что бензольные и гетероциклические кольца в них отделены от общего аминокислотного фрагмента метиленовой группой —СН2—. Стереоизомерия и амфотерность аминокислот. Стереоизомерия. Принцип построения аминокислот, т. е. нахождение у одного и того же атома углерода двух различных функциональных групп, радикала и атома водорода, уже сам по себе предопределяет хиральность альфа-атома углерода. Исключение составляет простейшая аминокислота глицин Н2N-СН2-СООН, не имеющая углеводородного радикала R и соответственно центра хиральности. Большинство аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные аминокислоты принадлежат к L-ряду.
Изолейцин, треонин, 4—гидроксипролин — содержат в молекуле по два центра хиральности. Эти аминокислоты могут существовать в виде четырех диастереомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Из этих четырех стереоизомеров для построения белков человеческого организма используется только один. Амфотерность аминокислот обусловлена наличием в их молекулах функциональных групп кислотного (СООН) и основного (NН2) характера. Поэтому аминокислоты образуют соли как со щелочами, так и с кислотами.
В твердом состоянии аминокислоты существуют в виде биполярных ионов; в водном растворе — в виде равновесной смеси биполярного иона, катионной и анионной форм. Положение равновесия зависит от рН среды. Общим для всех аминокислот является преобладание катионных форм в сильнокислых (pH 1—2) и анионных — в сильнощелочных (рH 13— 14) средах.
Ионное строение обусловливает некоторые особенности аминокислот: высокую температуру плавления (выше 200С), нелетучесть, растворимость в воде и нерастворимость в неполярных органических растворителях. Полностью протонированная аминокислота (катионная форма) с позиций теории Брёнстеда является двухосновной кислотой, содержащей две кислотные группы: недиссоциированную карбоксильную группу и протонированную аминогруппу, характеризующиеся соответствующими значениями рКа. Отдавая один протон, такая двухосновная кислота превращается в слабую одноосновную кислоту — биполярный нон с одной кислотной NН3-грулпой. Депротонирование биполярного нона приводит к получению анионной формы аминокислоты — ацилат-иону, являющемуся основанием Брёнстеда. 4) Классификации аминокислот. Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде: По функциональным группам Алифатические
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 922; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.01 с.) |

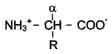






 Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы. Все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой. Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0).
Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы. Все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой. Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). 



