Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Металлы, их кристаллическое строение, свойстваСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Содержание Рабочая программа…………………………………………………………...…..4 Конспект лекций………………………………………………………………...10 Задание на контрольную работу с методическими указаниями…………..…79 Методические указания студентам ……………………………………………86 Методические указания преподавателям ……………………………………..87 Экзаменационные вопросы ………………………… ………………………...89 Экзаменационные билеты ………………………………………………….….92
Цели и задачи дисциплины Материаловедение – это комплексная наука, изучающая внутреннее строение и свойства материалов и закономерности их изменения под воздействием внешних факторов: тепловых, механических, химических, электромагнитных. Целью изучения дисциплины является получение студентами необходимых знаний для усвоения связей между составом, строением и свойствами материалов в зависимости от их обработки. Задачами изучения дисциплины является научить студентов правильно выбирать и использовать материалы для изготовления, эксплуатации и ремонта деталей механизмов и машин. Дисциплина основана на знаниях в области химии, физики, механики. Изучив дисциплину, студент должен знать и уметь использовать различные материалы с целью снижения массы и габаритов механизмов, повышения их эксплуатационной надежности и долговечности, ремонтопригодности и экономической эффективности. Студент должен иметь представление о перспективах развития материаловедения, о современных методах обработки и упрочнения деталей машин и конструкций. Содержание дисциплины Введение. Предмет и содержание курса. Роль и значение металлов и сплавов при производстве вагонов, локомотивов, рельсов и других изделий, используемых на железнодорожном транспорте. Раздел 1 Металлы, их кристаллическое строение, свойства Атомно-кристаллическая структура металлов. (6.1.1., 6.1.2., 6.1.3., 6.1.4., 6.2.1.) 2.1.2. Дефекты кристаллического строения металлов. (6.1.1., 6.1.2., 6.1.4., 6.2.1.) 2.1.3. Фазы и структура в металлических сплавах, свойства. (6.1.1., 6.1.2., 6.1.4., 6.2.1.) Раздел 2 Основы теории сплавов 2.2.1. Правило фаз. Диаграмма состояния сплавов, компоненты которых образуют неограниченные твердые растворы. (6.1.1., 6.1.2., 6.2.1.) 2.2.2. Диаграмма состояния сплавов, компоненты которых образуют механическую смесь. Правило отрезков. (6.1.1., 6.1.2., 6.1.4., 6.2.1., 6.2.2.) 2.2.3. Диаграмма состояния сплавов, компоненты которых образуют твердые растворы с ограниченной растворимостью и эвтектику. (6.1.1., 6.1.2., 6.1.4., 6.2.1., 6.2.2.) 2.2.4. Диаграмма состояния сплавов, образующих химические соединения. (6.1.1., 6.1.2., 6.2.1., 6.2.2.) 2.2.5. Связь диаграмм состояния со свойствами сплавов. (6.1.1., 6.1.2., 6.2.1., 6.2.2.) Раздел 3 Диаграмма состояний «железо-цементит» Классификация и маркировка сталей и чугунов 2.3.1. Диаграмма состояний «железо-цементит». (6.1.1., 6.1.2., 6.1.3., 6.1.4., 6.2.1., 6.2.2.) 2.3.2. Влияние углерода и постоянных примесей на свойства стали. (6.1.1., 6.1.2., 6.1.3., 6.1.4., 6.2.1.) 2.3.3. Углеродистые конструкционные стали. (6.1.1., 6.1.2., 6.1.4., 6.2.1.) 2.3.4. Легированные стали. (6.1.1., 6.1.2., 6.1.3., 6.1.4., 6.2.1.) 2.3.5. Чугуны. (6.1.1., 6.1.2., 6.1.3., 6.1.4., 6.2.1.) Раздел 4 Основы термической обработки стали 2.4.1. Фазовые превращения в сплавах железа. (6.1.1., 6.1.2., 6.1.4., 6.2.1.) Отжиг. (6.1.1., 6.1.2., 6.1.4., 6.2.1.) 2.4.3. Закалка и отпуск стали. (6.1.1., 6.1.2., 6.1.3., 6.1.4., 6.2.1.) 2.4.4. Поверхностная закалка стали. (6.1.1., 6.1.2., 6.1.4., 6.2.1.) Раздел 5 Химико-термическая обработка стали 2.5.1. Цементация. (6.1.1., 6.1.2., 6.1.4., 6.2.1.) 2.5.2. Цианирование, нитроцементация. (6.1.1., 6.1.2., 6.1.4., 6.2.1.) 2.5.3. Диффузионное насыщение стали металлами. (6.1.1., 6.1.2., 6.1.4., 6.2.1.) Раздел 6 Цветные металлы и сплавы на их основе 2.6.1. Титан и сплавы на его основе. (6.1.1., 6.1.2., 6.1.3., 6.1.4., 6.2.1.) Алюминий и сплавы на его основе. (6.1.1, 6.1.2., 6.1.3., 6.1.4., 6.2.1.) 2.6.3. Медь и сплавы на ее основе. (6.1.1., 6.1.2., 6.1.3., 6.1.4., 6.2.1.) 2.6.4. Антифрикционные сплавы. (6.1.1., 6.1.2., 6.1.3., 6.1.4., 6.2.1.) Раздел 7 Неметаллические материалы 2.7.1. Общие сведения. (6.1.1., 6.1.2., 6.1.3., 6.1.4.) 2.7.2. Пластические массы. (6.1.1., 6.1.2., 6.1.3., 6.1.4.) 2.7.3. Резиновые материалы. (6.1.1., 6.1.2., 6.1.3., 6.1.4.) 2.7.4. Неорганические полимерные материалы (6.1.1., 6.1.2., 6.1.3., 6.1.4.)
ВИДЫ РАБОТ С РАСПРЕДЕЛЕНИЕМ ВРЕМЕНИ Всего часов – 100 Лекционные занятия – 8 часа Лабораторный практикум – 8 часа Контрольная работа (количество) – 1 Самостоятельная работа – 84 часа Экзамен (количество) – 1
ПЕРЕЧЕНЬ ТЕМ ЛЕКЦИОННЫХ ЗАНЯТИЙ Примерный объем в часах
ПЕРЕЧЕНЬ ТЕМ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ Примерный объем в часах
ПЕРЕЧЕНЬ ТЕМ ДЛЯ ЛАБОРАТОРНОГО ПРАКТИКУМА Примерный объем в часах
ИНФОРМАЦИОННО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ 6.1. Обязательная литература 6.1.1. Материаловедение и технология конструкционных материалов для железнодорожной техники: Учебник для вузов ж.-д. трансп./ Н.Н. Воронин, Д.Г. Евсеев, В.В. Засыпкин и др.; Под ред. Н.Н. Воронина. – М.: Маршрут, 2004. – 456 с. 6.1.2. Материаловедение и технология конструкционных материалов: Учебник для вузов./[В.Б. Арзамасов, А.Н. Волчков, А.А. Головин и др.]; Под ред. В.Б. Арзамасова, А.А. Черепахина. – 2-е изд., стер. – М.: Издательский центр «Академия», 2009. – 448 с. 6.1.3. Зарембо Е.Г. Материаловедение и технология материалов: Учебное пособие. – М.: РГОТУПС, 2005. – 188 с. 6.1.4. Материаловедение и технология металлов: Учебник для студентов машиностроит. спец. вузов/ Г.П. Фетисов, М.Г. Карпман, В.М. Матюшин и др.; Под ред. Г.П. Фетисова. – М.: Высш. Шк., 2002. – 638 с. 6.2. Рекомендуемая литература 6.2.1. Гуляев А.П. Металловедение: Учебник для вузов. – М.: Металлургия, 1986. – 544 с. 6.2.2. Зарембо Е.Г. Материаловедение: Учебное иллюстрированное пособие. М.: 2008
ДИСЦИПЛИНЫ При освоении курса предполагается использовать следующее обеспечение: · Пресс Бринелля; · Пресс Роквелла; · Маятниковый копер; · Стенды с микроструктурами сталей, чугунов, цветных сплавов; · Микроскоп; · Плакат с диаграммой «железо-цементит»; · Плакаты с атомно-кристаллическими решетками металлов; · Плакат с диаграммой видов термической обработки сталей.
Материаловедение Конспект лекций
Металлические материалы. Получение и классификация. К металлам относятся >80 элементов периодической системы. Каждый металл имеет свои особенности, но все металлы обладают рядом характерных свойств: - высокой электро- и теплопроводностью, увеличивающимися с понижением температуры; - термоэлектронной эмиссией, т.е. способностью испускать электроны при нагреве; - хорошей светоотражательной способностью: металлы непрозрачны и обладают металлическим блеском; - повышенной способностью к пластической деформации. Наличие этих свойств и характеризует так называемое металлическое состояние вещества. Все металлы и сплавы можно разделить на 2 группы - черные и цветные. Черные металлы имеют темно-серый цвет. К ним относят железо и его сплавы (стали и чугуны). Железо обладает полиморфизмом - способностью изменять строение кристаллической решетки при нагреве до определенных температур. Цветные металлы в большинстве случаев окрашены в красный, желтый или белый цвет, для многих из них характерно отсутствие полиморфизма. В соответствии с температурой плавления и затвердевания металлы делятся на низкоплавкие (легкоплавкие) (tпл<2000°C), высокоплавкие (tпл=1000...2000°C), тугоплавкие (tпл>2000°C). По сходным свойствам металлы, в свою очередь, можно разделить следующим образом: а) железные металлы - железо (Fe), кобальт (Co), никель (Ni) - так называемые ферромагнетики и близкий к ним по свойствам марганец (Mn); б) тугоплавкие металлы - молибден (Mo), тонтал (Ta), вольфрам (W) и др.; в) урановые металлы - актиноиды, имеющие преимущественное применение в сплавах для атомной энергетики; г) редкоземельные металлы (РЗМ) - лантан (La), церий (Ce), неодим (Nd), празеодим (Pr) и др. д) щелочноземельные металлы в свободном металлическом состоянии применяются в особых случаях; е) легкие металлы - бериллий (Be), магний (Mg), алюминий (Al), обладающие малой плотностью; ж) благородные металлы - серебро (Ag), золото (Au), металлы платиновый группы: платина (Pt), палладий (Pd), иридий (Jr), родий (Rh), осмий (Os), рутений (Ru). К ним может быть отнесена и «полублагородная» медь (Cu); з) легкоплавкие металлы - цинк (Zn), кадмий (Cd), ртуть (Hg), олово (Sn), свинец (Pb), висмут (Bi), таллий (Tl), сурьма (Sb) и элементы с ослабленными металлическими свойствами - галлий (Ga), германий (Ge). Наибольшее распространение получило Fe в виде сплавов с углеродом (стали и чугуны), что обусловлено его механическими свойствами, возможностью массового изготовления, большой распространенностью его руд в природе и малой стоимостью. Способы получения: - чугунов - из руд в доменных печах, вагранках, индукционных печах; - стали - в мартеновских, электропечах, кислородных конвертерах. Внепечные методы рафинирования: циркуляционное вакуумирование, вакуум - камеры, вакуумирование в струе, обработка синтетическим шлаком, электрошлаковый переплав. Анизотропия в кристаллах. Все физические, включая и прочностные, свойства металлов вдоль различных кристаллографических направлений зависят от числа атомов, расположенных на упомянутых направлениях. В действительности в кристаллической решетке на различных направлениях находится разное число атомов. Например, в кубических решетках (см. рис.1.3) вдоль диагоналей куба О.Ц.К. решетки [111] или диагоналей граней решетки Г.Ц.К. [110], [101], [011] размещается больше атомов, чем по направлениям вдоль ребер кубов [100], [010], [001]. Из сказанного следует, что в кристаллических веществах должна наблюдаться анизотропия, т.е. неодинаковость свойств вдоль различных кристаллографических направлений. Наглядным и убедительным подтверждением наличия анизотропии является опыт с медным шаром, изготовленным из монокристалла. Если такой шар нагревать, то вследствие неодинаковости коэффициентов линейного расширения по различным направлениям он зримо утратит геометрически правильную форму шара и превратится в эллипсоид. Не всем свойствам кристаллических тел присуще явление анизотропии. Например, теплоемкость от направления не зависит. Следует особо подчеркнуть, что анизотропия проявляется только в пределах одного кристаллического зерна, или монокристалла. Реальные металлы являются телами поликристаллическими, состоящими из огромного числа зерен, произвольно ориентированных друг к другу своими кристаллографическими направлениями и плоскостями. В связи с этим недостаток какого-либо свойства по одному из направлений приложения силы в одних зернах компенсируется избытком этого свойства по этому же направлению в других зернах. Поэтому реальные металлы являются изотропными телами, т.е. телами с примерно одинаковыми свойствами по всем направлениям. Поскольку их изотропность является не истинной, а усреднённой, то их принято называть квазиизотропными или псевдоизотропными телами. Аллотропия металлов Некоторые металлы, например железо, титан, олово и др., способны по достижении определённых температур изменять свое кристаллическое строение, перестраивая тип элементарной ячейки. Так О.Ц.К. железо, будучи нагрето до 911°С, перестраивает кристаллическую решетку при этой температуре и становится Г.Ц.К. железом. Это строение сохраняется до 1392°С, после чего решетка снова перестраивается и приобретает О.Ц.К. строение, сохраняя его вплоть до температуры плавления 1539°С. Данное явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными. Основной причиной аллотропии является стремление любого вещества обладать минимальным запасом свободной энергии F, которая изменяется в зависимости от абсолютной температуры Т по формуле F = U-TS, где U - внутренняя энергия вещества, S - энтропия (термодинамическая функция) [энтропия является функцией состояния, её значение S = φ (p, V); S = φ (V, T) ]
Если у металла по достижении какой - то определённой температуры изменение типа кристаллической решетки обеспечивает уменьшение запаса свободной энергии, то такой металл претерпевает аллотропическое превращение. Разные аллотропические формы металлов обозначают буквами греческого алфавита, при этом низкотемпературные модификации обозначают буквой α, а последующие в порядке роста температуры - β,γ,δ и т.д. В связи с этим именно благодаря полиморфизму сплавы на основе железа, титана и др. металлов (обладающих данным свойством) можно подвергать термообработке для целенаправленного изменения их свойств. Таблица 1.2 Аллотропические свойства металлов
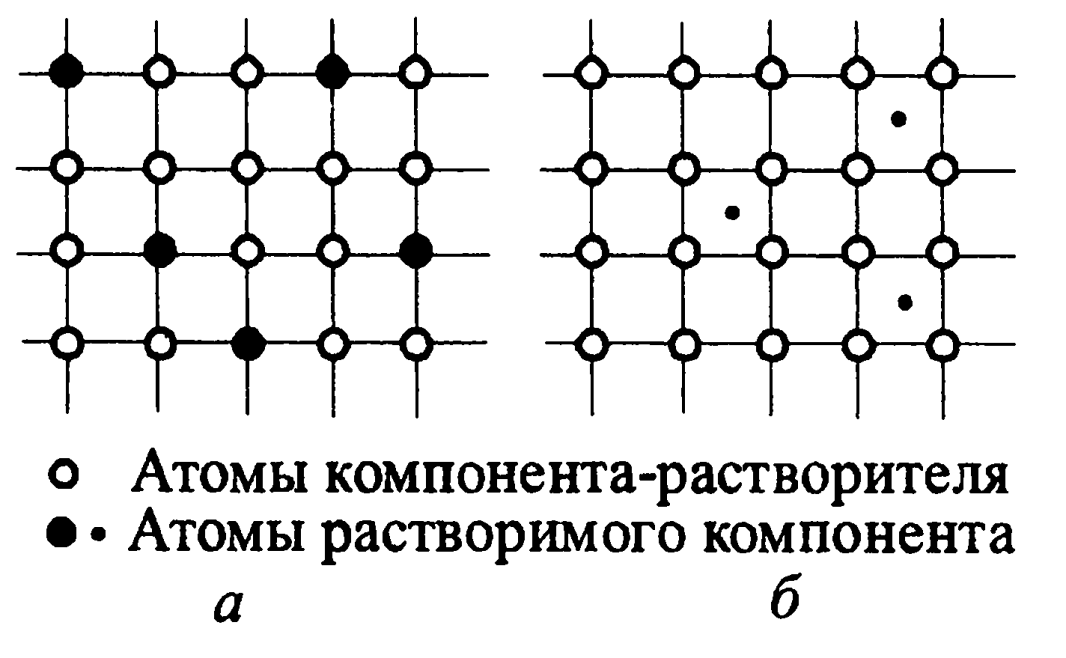
Магнитные превращения Кроме рассмотренных полиморфных превращений в металлах могут наблюдаться превращения, не приводящие к изменению типа решетки. Они заключаются в перестройках электронных оболочек, обусловленных изменением магнитных моментов. Такие превращения называются магнитными. Известно, что атомы металлов с полностью заполненными электронными оболочками (такие, как Na, K, Ag, Au, Cu и др.) не имеют результирующего магнитного момента. Эти вещества диамагнитны. Если же внутренняя электронная оболочка атомов заполнена не полностью (Fe, Co, Cr, Ni и др.), то такие атомы обладают определённым магнитным моментом, а сами вещества могут быть как ферромагнитными, так парамагнитными. Магнитные превращения заключаются в том, что многие вещества при изменении температуры могут переходить из одного состояния в другое: ферромагнетики (такие, как Fe, Co, Ni) при повышении температуры переходят в парамагнетики, а при понижении температуры некоторые ферромагнетики переходят в антиферромагнетики. Температура, выше которой ферромагнитные вещества ведут себя как парамагнетики, называется температурой Кюри (для Fe = 770°C, Ni = 358°C, Co = 1120°C); температура, ниже которой ферромагнетики переходят в антиферромагнитное состояние, называется температурой Нееля (Cr<38°C, и Mn<-100°C). Существуют и другие магнитные явления, такие как метамагнетизм, т.е. смещение температуры перехода от ферромагнитного к антиферромагнитному под действием магнитного поля (температура Нееля сдвигается в область более высоких температур). Магнитострикция – изменение размеров кристаллов при переходе металла из парамагнитного состояния в ферромагнитное (ниже точки Кюри) различное по величине для разных кристаллографических направлений. Магнитострикция может возникать и в результате намагничивания образца под воздействием приложенного внешнего магнитного поля. Константой магнитострикции λ называют относительное удлинение образца в направлении поля при его намагничивании до насыщения. Константа магнитострикции может быть положительной и отрицательной (т.е. образец под действием поля и в результате магнитных превращений может не только удлиняться, но и сжиматься). У никеля, например, λ отрицательна, при намагничивании никеля происходит уменьшение образца в направлении намагниченности; поэтому растяжение образца в магнитном поле затрудняет процесс намагничивания, сжатие же, наоборот, облегчает. У железа константа магнитострикции положительна, при намагничивании образец удлиняется в направлении магнитного поля. В монокристаллах константа магнитострикции зависит от кристаллографических направлений. Так, у Ni в направлении [100] λ[100]=-45,9 ∙ 10-6, а в направлении [111] λ[111]=-24,3 ∙ 10-6, т.е. изменяется почти в 2 раза. В поликристаллических веществах, как правило, магнитострикция изотропна, т.е. одинакова для любого направления образца. Материаловедам и конструкторам необходимо учитывать явления магнитострикции при выборе материала и конструировании деталей, особенно работающих в присутствии магнитных полей. Наклеп металла Из многолетнего опыта известно, что после ковки холодного металла заметно возрастают его прочность и твердость. В то же время он становится хрупким. Это явление получило название «наклеп». Наклепом называют как сам процесс изменения внутреннего строения металла при холодной пластической деформации, так и получающийся при этом результат, т.е. повышение прочности и твердости, сопровождающееся уменьшением пластичности. Свойства металлов Физические: магнитные, эл.проводность, теплопроводность, плотность, теплоемкость, температура плавления и др. Химические: коррозия Механические: прочность, твердость, пластичность, вязкость Технологические: литейные (жидкотекучесть, усадка), ковкость, свариваемость, обрабатываемость режущим инструментом Специальные: жаропрочность, жаростойкость, сопротивление коррозии, износостойкость. Виды двойных сплавов. В зависимости от природы, сплавляемых компонентов они, взаимодействуя друг с другом, могут образовать различные по строению и свойствам продукты. Характер взаимодействия компонентов при сплавлении зависит от их положения в таблице Д.И. Менделеева, особенностей строения электронных оболочек их атомов, типов и параметров их кристаллических решеток, соотношения температур их плавления, их атомных диаметров и других факторов. В зависимости от преобладания тех или иных перечисленных факторов компоненты при сплавлении могут образовывать: смеси своих зерен с пренебрежимо ничтожной взаимной растворимостью; неограниченно или частично растворяться друг в друге; образовывать химические соединения. Механическая смесь двух компонентов А и В образуется, если они не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. При этих условиях сплав будет состоять из кристаллов А и В, отчетливо выясняемых на микроструктуре. Механические свойства зависят от количества соотношения компонентов, Рис. 2.1. Виды твердых растворов а - замещения; б - внедрения
При растворении компонентов друг в друге образуются твердые растворы. Получающийся при этом продукт представляет собой зерна, кристаллическая решетка которых построена из атомов обоих компонентов. Если атомы растворимого компонента замещают в узлах решетки атомы компонента-растворителя, то образующийся раствор называется твердым раствором замещения (рис. 2.1, а). Такие растворы образуют компоненты с аналогичными типами кристаллических решеток при небольшой разнице их параметров. Если растворимый компонент имеет очень малый атомный диаметр, то образуется твердый раствор внедрения (рис. 2.1, б). В этом случае энергозатраты на образование раствора оказываются меньшими, т.к. атомы растворимого элемента (например, углерода в железе) размещаются в междоузлии ячейки кристаллической решетки. Компоненты с неограниченной растворимостью образуют только растворы замещения. Ограниченная растворимость наблюдается как у твердых растворов замещения, так и у растворов внедрения. При ограниченной растворимости компонентов за пределами их растворимости образуются или смеси зерен ограниченных твердых растворов обоих компонентов друг в друге (компонента А в В и компонента В в А), или смеси зерен ограниченного раствора и химического соединения компонентов. В твердых растворах замещения преобладающей связью между атомами является металлическая. В растворах внедрения в месте с металлической может возникать и ковалентная связь. Ковалентная связь на порядок сильнее металлической. Особенности межатомных связей в зернах твердых растворов предопределяют их прочностные и другие свойства. Образующиеся при сплавлении 2-х компонентов химические соединения имеют строго определённый состав. Они представляют собой зерна со специфической кристаллической решеткой, отличной от решеток обоих компонентов. Ячейки решеток имеют сложное строение. Связь между атомами в них сильнее и жестче металлической. Поэтому они являются очень твердыми и хрупкими веществами (Fe3C). Существует несколько видов химических соединений, отличающихся спецификой строения и свойств (здесь не рассматриваются). В связи с изложенным выше все существующие металлические сплавы можно разделить на 4 основных вида (рода): 1. Механическая смесь зерен компонентов; 2. Неограниченные твердые растворы (замещения); 3. Твердые растворы с ограниченной растворимостью; 4. Устойчивые химические соединения Диаграмма состояния Fe-C Диаграмма состояния Fe-C дает представление о строении сталей и чугунов (рис 3.6). Первое представление о диаграмме Fe-C дал Д.К.Чернов, который в 1868г. отметил существование в стали критических точек и их зависимость от содержания в стали углерода, т.е. по сути впервые указал на полиморфизм железа. Содержание углерода в диаграмме Fe-C ограничивается 6,67%, т.к. при этой концентрации образуется химическое соединение – карбид железа (Fe3C) или цементит, который и является вторым компонентом данной диаграммы. Система Fe- Fe3C метастабильная. Образование цементита вместо графита дает меньший выигрыш свободной энергии. Но кинетическое образование карбида железа более вероятно. Точка А (1539ºС) отвечает температуре плавления железа, точка D (1250ºС(1500 ºС)) – температуре плавления цемента, точка N (1392 ºС) и G (910 ºС) – соответствуют полиморфному превращению Feα ↔ Feγ. Концентрация углерода (по массе) для характерных точек диаграммы состояния (рис.3.6) следующая: В – 0,51% С в жидкой фазе, находящейся в равновесии с δ-феритом [Feδ(с)] и аустенитом [Feγ(с)], при перитектической реакции и при 1499 ºС; Н – 0,1% С в δ-ферите при 1490 ºС; J – 0,16% С – в аустените- перитектике при 1490 ºС; Е – 2,14% С предельное содержание в аустените при 1147 ºС; S – 0,8% С в аустените при реакции эвтектоидного превращения 727 ºС; Р – 0,02% С – предельное содержание в феррите [Feα(с)] при 727 ºС.
Обозначения линий диаграммы Fe-C:
АВ – линия ликвидуса – указывает температуру начала кристаллизации δ-ферита из жидкого сплава; ВС – линия ликвидуса – температуру начала кристаллизации аустенита (А) из Ж; CD – линия ликвидуса – начало кристаллизации первичного Fe3C I из Ж; АВCD – вся линия ликвидуса. Теперь рассмотрим линию солидуса: АН – температурная граница Ж и кристаллов δ-ферита; HJB – линия перитектической реакции – ЖВ+ФН ↔ АJ при 1490 ºС, т.е. жидкий расплав состава В взаимодействует с кристаллами δ-ферита состава Н с образованием аустенита состава J. ECF – линия солидуса – соответствует кристаллизации из жидкой фазы ледебурита – эвтектики ЖС ↔ Л (АЕ+ Fe3C) при 1147 ºС. AHJECF – линия солидуса.
Рис. 3.6 Диаграмма Fe- Fe3C
У Feα(с) и Feδ(с) один и тот же тип кристаллической решетки – ОЦК, твердый раствор внедрения углерода в Feδ(с) называют высокотемпературным ферритом. Feγ(с) имеет решетку ГЦК, твердый раствор внедрения углерода в Feγ(с). По своим свойствам феррит достаточно мягок и пластичен (σв=250(300) МПа; σ0,2=120 МПа; δ=50(30)%; ψ=80%; НВ80…90(650…1300)) магнитен до 768 ºС (линия МО) – в микроструктуре – светлая составляющая. Аустенит (А) – твердый раствор углерода в γ-железе. Предельная растворимость углерода в γ-железе 2,14%; решетка ОЦК (НВ 2000-2500; δ=40-50%), не магнитен. Цементит (Fe3C) – тверд, очень хрупок (НВ>8000 (800НВ)), имеет сложную орторомбическую кристаллическую решетку, это – химическое соединение железа и углерода. В системе (Fe- C) имеются две большие группы сплавов: стали и чугуны. Сталями называются сплавы железа и углерода, содержащие до 2,14% С; сплавы с большим содержанием углерода называют чугунами. Сталь, содержащую 0,8% С, называют эвтектоидной. Если в стали меньше 0,8% С, то её называют доэвтектоидной, а при содержании С > 0,8%, но < 2,14% С – заэвтектоидной. Структура доэвтектоидной стали состоит из феррита (светлая составляющая на микроструктуре) и перлита (темная составляющая), структура эвтектоидной стали состоит только из перлита; структура заэвтектоидной стали состоит из перлита (темная составляющая) и цементита вторичного (светлая составляющая в виде сетки). Перлит имеет пластинчатое строение, кристаллы Fe3CII перемежаются с кристаллами феррита. Эвтектоидную смесь, состоящую из феррита и цементита, называют перлитом. В реакции эвтектоидного превращения нет жидкой фазы и её могут записать в виде: Feγ(с)0,8 ↔ при температуре 727 ºС Feα(с)0,02 + Fe3CII Механические свойства перлита: НВ 1800, σв = 800 МПа, δ =10%. Чугунами называют сплавы железа и углерода, содержащие больше 2,14%. Доэвтектический С ≥ 2,14…< 4,3%, эвтектический С = 4,3% С, заэвтектический чугун 4,3<С<6,67%. Доэвтектический чугун имеет структуру: перлит + ледебурит (перлит + цементит) + вторичный цементит. Эвтектический чугун состоит только из ледебурита (перлит + Fe3CII). Заэвтектический чугун состоит из первичного цементита - Fe3CI, имеющего форму пластин, и ледебурита (перлит + Fe3CII). Графит – углерод в свободном состоянии – при распаде Fe3C при медленном охлаждении. Классификация сталей.
Стали классифицируются по химическому составу, качеству и назначению. По химическому составу классифицируют главным образом конструкционные стали, предназначенные для изготовления деталей машин и металлических конструкций. Конструкционные стали делят на углеродистые и легированные. Углеродистые стали могут быть - низкоуглеродистые: С ≤ 0,09 …0,25 %; - среднеуглеродистые: С ≤ 0,25 …0,45 %; - высокоуглеродистые: С ≤ 0,45 …0,75 %. Легированные стали условно подразделяют по содержанию легирующих элементов: низколегированные ≤ 2,5%; среднелегированные – 2,5…10%; высоколегированные – более 10%. По назначению стали подразделяют на конструкционные, инструментальные и стали и сплавы с особыми свойствами: жаропрочные, кислотостойкие, износостойкие, криогенные, магнитные и др. По качеству различают стали общего назначения, качественные, высококачественные и особовысококачественные, в последнем случае в маркировке указывается способ выплавки и последующей обработки стали. Под качеством стали понимают совокупность свойств, определяемых металлургическим процессом ее производства. Однородность химического состава, строения и свойств стали, а также ее технологичность во многом зависят от содержания газов (О2, Н2, N2) и вредных примесей – серы и фосфора. Стали обыкновенного качества содержат до 0,05% серы и 0,04% фосфора, качественные – не более 0,04% серы и 0,035% фосфора, высококачественные ≤ 0,025% серы и ≤0,025% фосфора, особовысококачественные - ≤ 0,015% серы и ≤ 0,025% фосфора. Стали углеродистые обыкновенного качества (ГОСТ 380-88) обозначаются индексом «Ст.» и порядковым номером, например, Ст.1, Ст.2, Ст.3, Ст.5. Чем выше номер в обозначении стали, тем выше ее прочность и ниже пластичность. По степени раскисления и характеру затвердевания стали классифицируют на спокойные (сп), полуспокойные (пс) и кипящие (кп). Раскисление – процесс удаления из жидкого металла О2, проводимый для предотвращения хрупкого разрушения стали при горячей деформации. Спокойные стали раскисляют Мn, Si и Аl. Кипящие стали раскисляют только Мn. Перед разливкой в них содержится повышенное количество О2, который при затвердевании, частично взаимодействуя с углеродом, удаляется в виде СО. Выделение пузырей СО создает впечатление кипения стали, с чем и связано ее название. Кипящие стали дешевы. Полуспокойные стали по степени раскисления занимают промежуточное положение между спокойными и кипящими. По структуре - (см. выше) доэвтектоидные, эвтектоидные и заэвтектоидные. Качественные углеродистые стали согласно ГОСТ 1050-88 маркируются цифрами, указывающими среднее содержание углерода в сотых долях процента: сталь 10, сталь 15, …, сталь 80. Содержание серы и фосфора в этих сталях не должно превышать 0,035%. Стали этой группы, содержащие свыше 0,2% С, выпускаются только спокойные. Углеродистые инструментальные стали (ГОСТ 1435-99) с С >0,7% имеют в обозначении букву «У» и цифру, указывающую на содержание углерода в десятых долях процентов: У7, У8,…,У13. Легированные конструкционные стали (ГОСТ 4543-71) в зависимости от содержания серы и фосфора подразделяются на качественные, высококачественные и особовысококачественные. Все высоколегированные стали содержат минимальное количество вредных примесей и являются высококачественными. Для придания особых свойств их подвергают дополнительной обработке специальными методами, которые отражены в обозначении сталей в конце наименования марки: ВD – вакуумно-дуговой переплав, Ш – электрошлаковый переплав, ВН – вакуумно-индукционная выплавка, СШ – обработка синтетическими шлаками.
Классификация чугунов Fe- Fe3C белые чугуны подразделяют на доэвтектические, эвтектические и заэвтектические. Из-за большого количества Fe3C они твердые (450…550НВ), хрупкие и для изготовления деталей машин не используются. Ограниченное применение имеют отбеленные чугуны – отливки из серого чугуна со слоем белого чугуна в виде твердой корки на поверхности. Из них изготавливают прокатные валки, лемеха плугов, тормозные колодки и другие детали, работающие в условиях износа. Белые чугуны часто используются для последующего передела в сталь (передельные) или в ковкий чугун (через специальный графитизирующий отжиг-томление, чтобы графит имел хлопьевидную форму). В промышленности широко применяют серые, высокопрочные и ковкие чугуны, в которых весь углерод или часть его находится в виде графита. Графит обеспечивает пониженную твердость, хорошую обрабатываемость резанием, а также высокие антифрикционные свойства вследствие низкого коэффициента трения. Серые, высокопрочные и ковкие чугуны различаются условиями образования графитовых включений и их формой, что отражается на их механических свойствах, которые в большей степени зависят от структуры механической основы. Прочность, твердость и износостойкость чугунов растут с увеличением количества перлита в металлической основе, которая по всем показателям близка к сталям. Признаки классификации чугуна: - по форме включений графита: серый чугун – с пластинчатым или с вермикулярным (завихренным или червеобразным) графитом, ковкий чугун – с хлопьевидным графитом и высокопрочный чугун с шаровидным графитом; - по характеру металлической основы (матрицы) – с ферритной, феррито-перлитной и перлитной структурой; По химическому составу: нелегированные чугуны и легированные – специального назначения. Серыми называются чу
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 862; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.015 с.) |