
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диаграммы состояний двойных систем.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Диаграмма состояний Fe - Fe3C. Классификация и маркировка сталей и чугунов. Диаграмма состояния - это график в координатах - состав сплава - температура, на котором отражены продукты, образующиеся в результате взаимодействия компонентов сплава друг с другом в условиях термодинамического равновесия при различных температурах. Этими продуктами являются вещества, имеющие в зависимости от температуры и состава определенное агрегатное состояние, специфический характер строения и вполне определенные свойства. Их принято называть фазами. Фаза – однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяется скачком. Жидкая фаза представляет собой раствор расплавленных компонентов. Твердые фазы являются зернами, имеющими определенную форму, размер, состав, специфику строения и свойства. Твердые фазы можно наблюдать в микроскоп. Это могут быть твердые растворы, химические соединения. А так же зерна чистых компонентов, не образующих с другими компонентами ни твердых растворов, ни химических соединений. Диаграмма состояния разделена линиями на области. Отдельные области могут состоять только из одной фазы, а некоторые – из двух, имеющих разные составы, строение и свойства. Анализируя диаграмму состояния, можно составить представление о специфике свойств сплавов данной системы компонентов и характере их изменения в зависимости от состава, а также о возможности термической обработки сплавов и температуре нагрева для её проведения.
Рис.3.1 Диаграмма состояния I рода (а) и схемы получающихся структур (б) Данная диаграмма охватывает сплавы, компоненты которых образуют механические смеси своих практически чистых зерен при ничтожной взаимной растворимости (рис.3.1). на оси абсцисс отложена доля компонента В в сплаве в процентах. Фазовое строение сплавов на диаграмме зависит от температуры. При термодинамическом воздействии компонентов друг на друга снижается температура их перехода в жидкое состояние, достигая некоторого минимума при определенном для каждой пары компонентов составе (рис.3.1, т.С). состав сплава можно определить, спроецировав т.С на ось абсцисс (т.ВЭ). Сплав двух компонентов, который плавится при минимальной температуре, называется эвтектическим или эвтектикой. Эвтектика – равномерная смесь одновременно закристаллизовавшихся мелких зерен обоих компонентов. Температура, при которой одновременно плавятся или кристаллизуются оба компонента, называется эвтектической температурой tЭ. На диаграмме состояния температуры, выше которых сплавы находятся в жидком состоянии, лежат на линии АСВ, называемой линией ликвидуса (рис.3.1, а) (от латинского «ликвидус» - жидкий, текучий). Переход сплавов из жидкого состояния в твердое при кристаллизации происходит в интервале температур, лежащих между линией ликвидуса и эвтектической температурой, которой соответствует линия солидуса DCE (от латинского «солидус» - твердый). При этом из каждого сплава по мере снижения температуры в твердую фазу переходит в начале тот компонент, количество которого превышает эвтектическую концентрацию (рис.3.1, б). поэтому у доэвтектических сплавов двухфазная область ACD содержит избыточный компонент А, а в заэвтектической области ВСЕ находятся соответственно твердая В и жидкая Ж фазы. В обоих случаях фаза Ж является жидким раствором обоих компонентов. Количественные изменения в сплавах данной системы комплектов (касающиеся состава твердой и жидкой фаз и их долей в единице массы любого сплава) при кристаллизации подчиняются правилу отрезков. Воспользуемся этим правилом на примере затвердевания сплава 1 (рис.3.1). Определим составы и число фаз при произвольно взятой температуре, соответствующей изотерме lts. При данной температуре состав жидкой фазы всех заэвтектических сплавов, включая и сплав 1, будет одинаковым, равный значению Вl. Состав твердой фазы будет соответствовать 100% компонента В. Таким образом, при кристаллизации сплавов состав жидкой фазы изменяется по линии ликвидуса от исходного до эвтектического. Масса твердой фазы при данной температуре определяется величиной отрезка lt, а жидкой – отрезка ts. Если массу всего сплава Q выразить через ls, то относительные доли твердой QВ и жидкой QЖ фаз можно представить в виде
Пользуясь этими выражениями, можно вычислить и абсолютные массовые доли каждой из фаз при любой температуре. Доэвтектические сплавы содержат компонента А свыше (100-ВЭ)%. В них он является избыточным компонентом. В заэвтектических сплавах избыточным является компонент В. В них его количество превышает ВЭ. При температурах ниже линии солидуса фазовый состав всех сплавов системы состоит из зерен обоих компонентов: А+В. Следует различать присутствующие в любом сплаве мелкие зерна А и В, составляющие эвтектику, и крупные зерна избыточных фаз – компонентов А или В соответственно в доэвтектических и заэвтектических сплавах (рис.3.1, б). Для более точной оценки прочностных и других свойств затвердевших сплавов целесообразно учитывать наличие эвтектики в их структурно-фазовом составе (рис.3.1, б). Так, структура доэвтектических сплавов состоит из А+Эвт (А+В) (см.сплав 2), а структура заэвтектических – из В+Эвт (А+В) (сплав 1), т.е. имеются крупные и мелкие одноименные зерна. Количество каждой структурной составляющей, от которого зависят свойства сплава, может быть вычислено по правилу отрезков применительно к эвтектической температуре.
Рис. 3.2 Зависимость характера изменения прочности сплавов от рода диаграммы состояния Если бы размер зерен у всех структурных составляющих сплавов был одинаков, то прочность изменялась бы строго по линейному закону (рис.3.2, а; АВ). Такое изменение свойств обусловлено законом аддитивности, согласно которому каждая из двух фаз вносит в суммарную прочность сплава часть своей прочности, соответствующей доле этой фазы в сплаве. В связи с этим прочность любого сплава σ может быть вычислена по формуле
где η – доля фазы А в структуре сплава; σА и σВ - прочности фаз А и В. Поскольку эвтектическая часть сплава обладает более высокой прочностью, фактическое изменение этого свойства будет происходить по кривой АСВ (рис.3.2, а). Аналогично с учетом их характера и в зависимости от состава изменяются и другие свойства сплавов (полная реакция сплава на внешнее воздействие складывается из реакций зерен обеих фаз). 3.2 Диаграмма состояний II рода (твердый раствор с неограниченной растворимостью)
Рис. 3.3 Диаграмма состояния II рода (а); характер кристаллизации сплавов и схема их фазового строения (б) На диаграмме можно различить три фазовые области (рис.3.3, а) 1. Выше линии ликвидуса АСВ находится область жидкой фазы Ж. 2. Под ней до линии солидуса ADB расположена двухфазная область α+Ж. Фаза α представляет собой твердый раствор компонентов А и В. Зерна этой фазы имеют единую кристаллическую решетку. Однако, у сплавов разного состава число атомов компонентов А и В в элементарных ячейках различно. 3. Область, расположенная под линией солидуса, является однофазной (фаза α). В отличие от сплавов смесей зерен практически чистых компонентов каждый из затвердевших сплавов на рассматриваемой диаграмме состояния представляет собой совокупность внешне ничем не отличающихся друг от друга зерен фазы α (рис.3.3, б). Кристаллизация α – фаз в сплавах разного состава происходит в соответствии с правилом отрезков. Если проследить специфику кристаллизации какого-нибудь из сплавов, например сплава 1 (рис.3.3), то, согласно правилу отрезков, в двухфазной области составы жидкой и твердой фаз в зависимости от температуры изменяются соответственно по линиям ликвидуса и солидуса (рис.3.3, а; изотермы 1, 2, 3 и 4). Составы жидкой фазы от точки l1 до l4 выражаются через Количество из сосуществующих при каждой из температур фаз α и Ж определяется соответствующими отрезками изотерм. Причем, отрезки, находящиеся слева от вертикали 1, определяют количество фазы α. Длины отрезков, находящихся справа, пропорциональны количеству фазы Ж. В случае равновесной кристаллизации, происходящей при достаточно малой скорости охлаждения сплава, к концу кристаллизации (изотерма 4) состав окончательно сформировавшейся фазы α4 должен соответствовать исходящему составу сплава В1 (в данном случае сплава 1). Это обусловлено непрерывно происходящей диффузией между обеими фазами. В случае ускоренного охлаждения сплава при кристаллизации диффузионные процессы не успевают завершиться. В связи с этим центральная часть каждого зерна оказывается обогащенной более тугоплавким компонентом (в данном случае В), а периферийная – легкоплавким компонентом (А). Это явление называется дендритной ликвацией, снижающей прочностные и другие свойства сплавов. Ее предотвращение возможно за счет медленного охлаждения сплава, обеспечивающего его равновесную кристаллизацию. В случае возникновения дендритной ликвации она может быть устранена путем длительного, так называемого диффузионного отжига сплава. Происходящие при этом диффузионные процессы выравнивают химический состав в зернах. У сплавов – твердых растворов – прочность и другие свойства зависимости от состава изменяются по криволинейному закону (рис.3.2, б).
Рис.3.4 Диаграмма состояний III рода
Диаграмма состояний III рода характерна для сплавов, образующихся при сплавлении компонентов, имеющих ограниченную растворимость друг в друге. Рассмотрим случай, когда за пределами растворимости компонентов образуются механические смеси твердых растворов на основе каждого из них (рис.3.4). На диаграмме состояний представлены: жидкая фаза Ж (выше линии ликвидуса ADB); две области (α+Ж) и (β+Ж) (лежащие между линиями ликвидуса и солидуса (АСЕВ)); две области ограниченных твердых растворов α и β (лежащие ниже отрезков линии солидуса, соответственно АС и ВЕ) и двухфазная область (α+β) (расположенная под отрезком линии солидуса СЕ). Фаза α является твердым раствором компонента В в А. Фаза β представляет собой твердый раствор компонента А в В. Взаимная растворимость компонентов друг в друге, как правило, зависит от температуры. Кривые CF и ЕК отражают характер изменения растворимости в зависимости от температуры соответственно компонента В в α-фазе и компонента А в β-фазе. Составы фаз при любой температуре можно определить, опустив на ось концентраций перпендикуляры из соответствующих точек, лежащих на линиях CF и ЕК. При t1 и t2 составы фаз α и β: α1, α2 и β1, β2. В структурно - фазовом составе сплавов данной системы важное место занимает эвтектика, представляющая собой смесь мелкозернистых фаз α и β. Она имеет определенный состав и кристаллизуется при наименьшей для данной системы температуре tЭ, т.е. на линии СЕ. Ниже этой линии находится область двухфазных сплавов. В ней структура доэвтектических сплавов состоит из первичных зерен α-фазы, равномерно распределенных в эвтектике Э (α+β), и зерен вторичной βII-фазы, выделившейся из твердой фазы α при снижении температуры. Заэвтектические сплавы соответственно состоят из первичной β-фазы, эвтектики и зерен вторичной фазы αII. Для уяснения характера обусловленного снижением температуры распада фаз α и β, сопровождающегося выделением фаз βII и αII, заметим, что в доэвтектических сплавах в результате неизбежного при их охлаждении распада имеющейся в них β-фазы (в эвтектике и βII) также образуется и вторичная α-фаза (αII). Однако, на диаграмме состояний это не указывается, т.к. при выделении фаза αII сливается с окружающими ее зернами первичной фазы α и как самостоятельная структурная составляющая не наблюдается. То же можно сказать о βII в заэвтектических сплавах. На рис.3.2, в показан характер изменения прочности сплавов рассматриваемой системы в зависимости от состава. Как и следовало ожидать, в однофазных областях твердых растворов α и β, свойства изменяются по криволинейному закону, а в двухфазной области (α+β) – по закону аддитивности с учетом влияния имеющейся в сплавах мелкозернистой эвтектики (рис.3.2, в). Подобным образом изменяются и другие свойства сплавов, охватываемых диаграммой состояний III рода.
Рис. 3.5 Диаграмма состояний IV рода
Диаграмма состояний IV рода относится к случаю, когда сплавляемые компоненты при соотношении АmBn образуют устойчивое химическое соединение, не диссоциирующее при нагреве вплоть до температуры плавления. В связи с этим его правомерно рассматривать в качестве самостоятельного компонента, способного образовывать сплавы с каждым из исходных компонентов. Соединение АmBn при сплавлении с компонентами А и В в зависимости от их природы может образовывать с ними различные по характеру системы (рис.3.5). компонент АmBn образует с компонентами А и В сплавы, относящиеся к диаграмме состояний I рода. В связи с этим фазовый состав любого сплава системы А-В в твердом состоянии должен представлять смесь химического соединения и одного из исходных компонентов. Уровень свойств сплавов и характер их изменения в зависимости от состава в этом случае должны изменяться по закону аддитивности (рис.3.2, а) с учетом влияния эвтектики. Характер изменения свойств сплавов в зависимости от состава предопределяется диаграммой состояния.
Правило фаз (закон Гиббса)
С=К+2-Ф С – число степеней свободы (число независимых переменных – концентрация фаз, температура и давление), которые могут быть изменены, но при этом число фаз Ф, находящихся в равновесии останется неизменным; К – число компонентов, входящих в систему; 2 – число внешних факторов (температура и давление). При нормальных условиях (Р=const): С=К+1-Ф Число С может быть только целым, положительным. Поэтому К-Ф+1≥0 Следовательно: - в чистом металле (К=1) число фаз, Ф≤К+1≤1+1≤2; - в двойной системе (К=2) Ф≤К+1≤2+1≤3; - в тройной системе (К=3) Ф≤3+1≤4 и т.д. При числе степеней свободы системы С=0 – равновесие нонвариантное (безвариантное); С=1 – моновариантная система; С=2 – бивариантная система
Диаграмма состояния Fe-C Диаграмма состояния Fe-C дает представление о строении сталей и чугунов (рис 3.6). Первое представление о диаграмме Fe-C дал Д.К.Чернов, который в 1868г. отметил существование в стали критических точек и их зависимость от содержания в стали углерода, т.е. по сути впервые указал на полиморфизм железа. Содержание углерода в диаграмме Fe-C ограничивается 6,67%, т.к. при этой концентрации образуется химическое соединение – карбид железа (Fe3C) или цементит, который и является вторым компонентом данной диаграммы. Система Fe- Fe3C метастабильная. Образование цементита вместо графита дает меньший выигрыш свободной энергии. Но кинетическое образование карбида железа более вероятно. Точка А (1539ºС) отвечает температуре плавления железа, точка D (1250ºС(1500 ºС)) – температуре плавления цемента, точка N (1392 ºС) и G (910 ºС) – соответствуют полиморфному превращению Feα ↔ Feγ. Концентрация углерода (по массе) для характерных точек диаграммы состояния (рис.3.6) следующая: В – 0,51% С в жидкой фазе, находящейся в равновесии с δ-феритом [Feδ(с)] и аустенитом [Feγ(с)], при перитектической реакции и при 1499 ºС; Н – 0,1% С в δ-ферите при 1490 ºС; J – 0,16% С – в аустените- перитектике при 1490 ºС; Е – 2,14% С предельное содержание в аустените при 1147 ºС; S – 0,8% С в аустените при реакции эвтектоидного превращения 727 ºС; Р – 0,02% С – предельное содержание в феррите [Feα(с)] при 727 ºС.
Обозначения линий диаграммы Fe-C:
АВ – линия ликвидуса – указывает температуру начала кристаллизации δ-ферита из жидкого сплава; ВС – линия ликвидуса – температуру начала кристаллизации аустенита (А) из Ж; CD – линия ликвидуса – начало кристаллизации первичного Fe3C I из Ж; АВCD – вся линия ликвидуса. Теперь рассмотрим линию солидуса: АН – температурная граница Ж и кристаллов δ-ферита; HJB – линия перитектической реакции – ЖВ+ФН ↔ АJ при 1490 ºС, т.е. жидкий расплав состава В взаимодействует с кристаллами δ-ферита состава Н с образованием аустенита состава J. ECF – линия солидуса – соответствует кристаллизации из жидкой фазы ледебурита – эвтектики ЖС ↔ Л (АЕ+ Fe3C) при 1147 ºС. AHJECF – линия солидуса.
Рис. 3.6 Диаграмма Fe- Fe3C
У Feα(с) и Feδ(с) один и тот же тип кристаллической решетки – ОЦК, твердый раствор внедрения углерода в Feδ(с) называют высокотемпературным ферритом. Feγ(с) имеет решетку ГЦК, твердый раствор внедрения углерода в Feγ(с). По своим свойствам феррит достаточно мягок и пластичен (σв=250(300) МПа; σ0,2=120 МПа; δ=50(30)%; ψ=80%; НВ80…90(650…1300)) магнитен до 768 ºС (линия МО) – в микроструктуре – светлая составляющая. Аустенит (А) – твердый раствор углерода в γ-железе. Предельная растворимость углерода в γ-железе 2,14%; решетка ОЦК (НВ 2000-2500; δ=40-50%), не магнитен. Цементит (Fe3C) – тверд, очень хрупок (НВ>8000 (800НВ)), имеет сложную орторомбическую кристаллическую решетку, это – химическое соединение железа и углерода. В системе (Fe- C) имеются две большие группы сплавов: стали и чугуны. Сталями называются сплавы железа и углерода, содержащие до 2,14% С; сплавы с большим содержанием углерода называют чугунами. Сталь, содержащую 0,8% С, называют эвтектоидной. Если в стали меньше 0,8% С, то её называют доэвтектоидной, а при содержании С > 0,8%, но < 2,14% С – заэвтектоидной. Структура доэвтектоидной стали состоит из феррита (светлая составляющая на микроструктуре) и перлита (темная составляющая), структура эвтектоидной стали состоит только из перлита; структура заэвтектоидной стали состоит из перлита (темная составляющая) и цементита вторичного (светлая составляющая в виде сетки). Перлит имеет пластинчатое строение, кристаллы Fe3CII перемежаются с кристаллами феррита. Эвтектоидную смесь, состоящую из феррита и цементита, называют перлитом. В реакции эвтектоидного превращения нет жидкой фазы и её могут записать в виде: Feγ(с)0,8 ↔ при температуре 727 ºС Feα(с)0,02 + Fe3CII Механические свойства перлита: НВ 1800, σв = 800 МПа, δ =10%. Чугунами называют сплавы железа и углерода, содержащие больше 2,14%. Доэвтектический С ≥ 2,14…< 4,3%, эвтектический С = 4,3% С, заэвтектический чугун 4,3<С<6,67%. Доэвтектический чугун имеет структуру: перлит + ледебурит (перлит + цементит) + вторичный цементит. Эвтектический чугун состоит только из ледебурита (перлит + Fe3CII). Заэвтектический чугун состоит из первичного цементита - Fe3CI, имеющего форму пластин, и ледебурита (перлит + Fe3CII). Графит – углерод в свободном состоянии – при распаде Fe3C при медленном охлаждении.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 2387; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.245.172 (0.013 с.) |


 и
и  (3.1)
(3.1)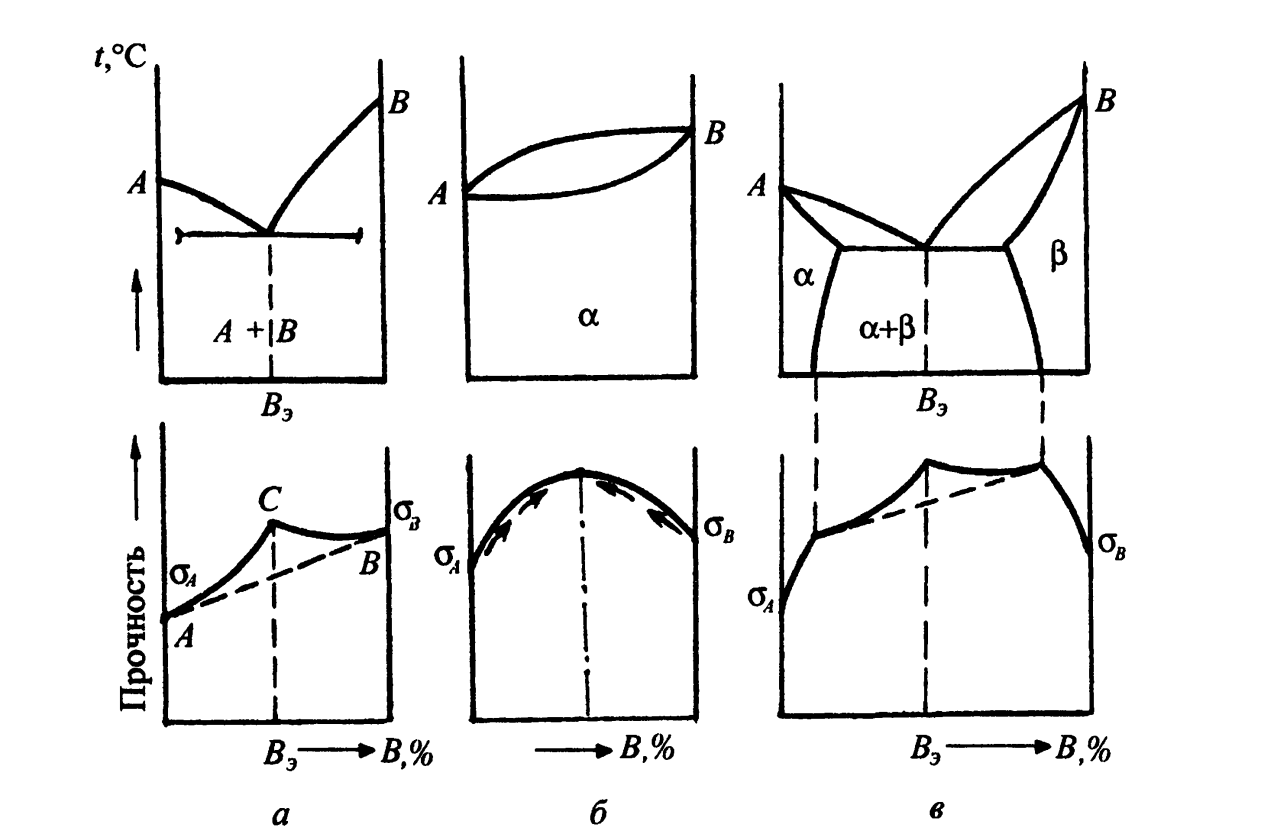
 (3.2)
(3.2)
 ,
,  ,
,  и
и  , а составы твердой фазы α изменяются от
, а составы твердой фазы α изменяются от  ,
,  ,
,  до
до  = В1.
= В1.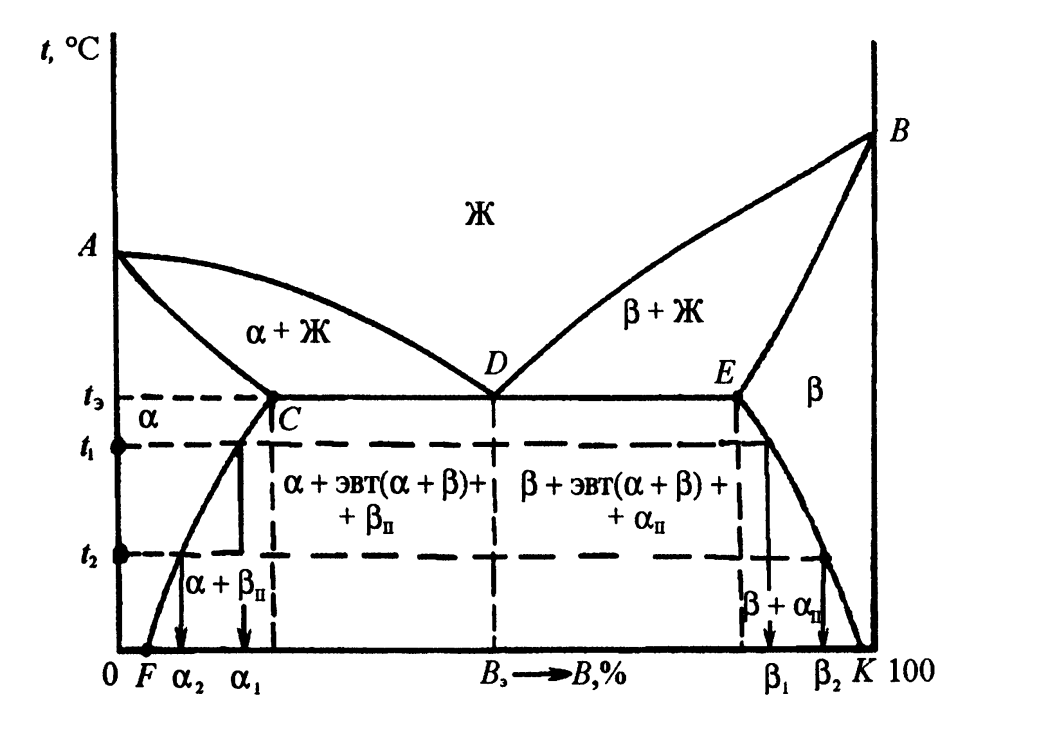
 3.4 Диаграмма состояний IV рода (химические соединения)
3.4 Диаграмма состояний IV рода (химические соединения)



