
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие сведения о построении диаграмм состоянияСодержание книги
Поиск на нашем сайте
Диаграмма состояния показывает изменение состояния в зависимости от температуры (давление постоянно) и концентрации. Если система однокомпонентна, то диаграмма состояния будет представлена в виде одной оси - шкалы температур, и соответствующие точки на прямой покажут равновесную температуру изменения агрегатного состояния вещества (рис 27, а). Если в системе два компонента, то вторая ось покажет концентрацию сплава. Диаграмму в этом случае строят в двух измерениях: температура и концентрация. По оси ординат откладывают температуру, по оси абсцисс – концентрацию. Общее содержание обоих компонентов в сплаве равно 100%, каждая точка на оси абсцисс соответствует определенному содержанию каждого компонента (рис. 27,б). В точке С 40% компонента В и 60% компонента А. По мере удаления от точки А увеличивается количество компонента В. Крайние ординаты на диаграмме соответствуют чистым компонентам, а ординаты между ними – двойным сплавам.
а б Рис.27. Координаты для изображения диаграммы состояния: а) однокомпонентной системы, б) двухкомпонентной системы
Диаграмма состояния сплавов с тремя компонентами имеет пространственный вид (две оси концентрации, одна - температур). Четырехкомпонентную систему и системы с большим числом компонентов изображают в виде пространственных диаграмм, но с некоторыми упрощениями. Каждая точка на диаграмме состояния показывает состояние сплава данной концентрации при данной температуре. Каждая вертикаль соответствует изменению температуры определенного сплава. Изменение фазового состояния сплава отмечается на диаграмме точкой. Линии, соединяющие точки аналогичных превращений, разграничивают на диаграмме области аналогичных фазовых состояний. Вид диаграммы состояния зависит от того, как реагируют оба компонента друг с другом в твердом и жидком состоянии, т.е. растворимы ли они в твердом и жидком состояниях, образуют они химические соединения и т.д. Типы диаграмм состояния 7.2.1. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода) Оба компонента в жидком состоянии неограниченно растворимы, а в твердом состоянии нерастворимы и не образуют химических соединений. Общий вид диаграммы состояния I рода показан на рис.28.
Рис.28. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода)
Компоненты: вещества А и В (k=2). Фазы: жидкость, кристаллы А и кристаллы В (максимальное значение f=3). Линия АСВ – линия ликвидус – начало кристаллизации, DCE – линия солидус – конец кристаллизации. На линии АС начинают при охлаждении выделяться кристаллы А, а на линии СВ – кристаллы В. На линии DCE из жидкости концентрации С одновременно выделяются кристаллы А и В. На рис. 29 показаны кривые охлаждения для сплавов I, II, III. Кривая охлаждения доэвтектического сплава (сплав I). Вначале охлаждается жидкий расплав (до т.1). Затем из жидкого расплава начинают выделяться кристаллы А (до т.2). Участок 2-2/ совместно выделяются кристаллы А и В. Потом происходит охлаждение твердого тела. На рисунках рядом с кривыми охлаждения показано схематически строение сплавов в разные моменты кристаллизации. Из жидкости (левый рисунок) выделяются кристаллы А, затем оставшаяся жидкость кристаллизуется с одновременным выделением кристаллов А и В. На крайнем правом рисунке показана структура уже закристаллизовавшегося металла. Видны первичные выделения кристаллов А и механическая смесь кристаллов А и В.
Рис.29. Кривые охлаждения сплавов: а - доэвтектического, б - эвтектического, в - заэвтектического.
Механическая смесь двух и более видов кристаллов, кристаллизующихся одновременно, называется эвтектикой. Кривая охлаждения сплава эвтектической концентрации (сплав II) показывает следующие стадии: охлаждение жидкого расплава, кристаллизация эвтектики, охлаждение закристаллизовавшегося сплава. Кривая охлаждения заэвтектического сплава (III) иллюстрирует: охлаждение жидкости, выделение кристаллов В из расплава, кристаллизация эвтектики (А+В), охлаждение закристаллизовавшегося сплава. Правило отрезков В процессе кристаллизации изменяются и концентрация фаз, и количество каждой фазы. В любой точке диаграммы, когда в сплаве одновременно существуют две фазы, можно определить количественное соотношение обеих фаз и их концентрацию. Для этого пользуются правилом отрезков, или правило рычага.
Рис.30. Диаграмма состояния (к применению на ней правила отрезков)
Чтобы определить концентрации компонентов в фазах, через данную точку, характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область (рис.30). Проекции точек пересечения на ось концентраций показывает составы фаз. Для того чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками, определяющими составы фаз, обратно пропорциональны количествам этих фаз. Правило отрезков можно применить только для двухфазных областей. Любая точка внутри однофазной области характеризует ее концентрацию.
7.2.2. Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии (II рода) Оба компонента неограниченно растворимы в жидком и твердом состоянии и не образуют химических соединений (рис 31). Компонента: А и В. Фазы: L и a. Кристаллизация при постоянной температуре не наблюдается, и горизонтальной линии на диаграмме нет. Диаграмма состоит из трех областей: жидкости L, жидкости и твердого раствора a, твердого раствора. Линия АnB – линия солидус, AmB – линия ликвидус. Т.1 соответствует началу кристаллизации. Т.2. - конец кристаллизации. Между точками 1 и 2 сплав находится в двухфазном состоянии.
Рис.31. Диаграмма состояния (неограниченная растворимость в твердом состоянии) и кривая охлаждения (II рода).
При двух компонентах и двух фазах система моновариантна (С=2-2+1=1), т.е. если изменяется температура, то изменяется и концентрация компонентов в фазах. Каждой температуре соответствуют строго определенные составы фаз. Концентрация и количественное соотношение фаз у сплава, лежащего между линиями ликвидус и солидус, определяется правилом отрезков. Состав жидкой фазы определяется проекцией точки b, лежащей на линии ликвидус, а состав твердой фазы – проекцией точки с, лежащей на линии солидус. Количество жидкой и твердой фаз определяется из следующих соотношений: количество жидкой фазы ac/bc, количество твердой фазы ba/bc. При кристаллизации из жидкости вначале выделяются тугоплавкие компоненты. Состав первых кристаллов определяется проекцией s. Состав жидкости изменяется по кривой 1-l, а состав кристаллов – по кривой s-2. В момент окончания кристаллизации состав кристаллов такой же, как и состав исходной жидкости. 7.2.3. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (III рода) Оба компонента неограниченно растворимы в жидком состоянии, ограниченно - в твердом и не образуют химических соединений. Компонента: А и В. Фазы: L,a, b. В сплавах такого рода возможно существование: жидкой фазы, твердого раствора компонента В в А (a -раствор) и твердого раствора А в В (b -раствор). В сплавах возможно нонвариантное равновесие при одновременном существовании трех фаз. В зависимости от того, какая реакция протекает в условиях существования трех фаз, могут быть два вида диаграмм: диаграмма с эвтектикой и диаграмма с перитектикой. Диаграмма с эвтектикой В этой системе не образуются фазы, представляющие собой чистые компоненты (рис.32). Из жидкости выделяются твердые растворы. Предельная растворимость компонента В в А определяется линией DF, а предельная растворимость А в В – линией CG. Сплавы, расположенные между этими двумя линиями находятся за пределами растворимости и состоят из двух фаз a + b.
Рис.32. Диаграмма состояния с эвтектикой (III рода)
Окончание кристаллизации происходит по эвтектической реакции L®a+b AEB – линия ликвидус, ADCB – линия солидус. Кривые охлаждения и схемы структур для сплавов I и II показаны на рис.33. Кристаллы b, выделившиеся из твердого раствора, называются вторичными кристаллами (bII), в отличие от первичных, выделившихся из жидкости. Процесс выделения вторичных кристаллов из твердой фазы – вторичная кристаллизация. Сплав, концентрация которого лежит левее точки F, не буде иметь вторичных выделений b -кристаллов. Для любых сплавов выделения вторичных a -кристаллов не будет, т.к. линия CG в отличии от FD вертикальна, т.е. растворимость компонента А в В не зависит от температуры.
Рис.33. Кривые охлаждения и схемы структур: а - сплава, образующего при кристаллизации твердый раствор с последующим выделением вторичной фазы, б - доэвтектического сплава.
Диаграмма с перитектикой При эвтектическом превращении жидкость кристаллизуется с образованием двух твердых фаз. Возможен и другой тип нонвариантного превращения (трехфазного равновесия), когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов L+b®a. Реакция такого типа называется перитектической (рис.34). На диаграмме показаны три однофазные области: жидкость L и ограниченные твердые растворы a и b. Линия АВС является линией ликвидус, линия APDB – линией солидус.
Кривые охлаждения и схемы структур сплавов I, II показаны на рис. 35. Количественное соотношение фаз при перитектической реакции, необходимое для образования a -фазы, определяется по правилу отрезков соотношением: Количество b / количество L=CP/PD
Рис.35. Кривые охлаждения сплавов после окончания перитектической реакции, в которых в избытке остаются: а) - твердый раствор, б) - жидкая фаза
В рассматриваемом сплаве количество участвующих в перитектической реакции кристаллов b и жидкости определяется соотношением
Количество b / количество L=C2/2D.
7.2.4. Диаграмма состояния для сплавов, образующих химические соединения (IV рода) Химическое соединение характеризуется определенным соотношением компонентов, а это отражается на диаграмме состояния вертикальной линией, проходящей на оси абсцисс через точку, отвечающую соотношению компонентов в химическом соединении. Если компоненты А и В образуют химическое соединение АnВm, то, следовательно, на n + m его атомов приходится n атомов А и m атомов В. Химическое соединение устойчиво, если его можно нагреть без разложения до расплавления, и неустойчиво, если при нагреве оно разлагается. В зависимости от этого могут быть два вида диаграмм. Кроме того, возможно образование нескольких химических соединений между двумя компонентами, а также растворимость на базе химического соединения – эти обстоятельства также находят отражение в диаграмме. А) Диаграмма с устойчивым химическим соединением Предположим, что оба компонента образуют одно устойчивое соединение АnВm, причем и это соединение, и чистые компоненты не образуют в твердом состоянии растворов (рис.36).
Рис.36. Диаграммы состояния с устойчивыми химическими соединениями (IV рода)
Компонентами системы являются вещества А и В, а твердыми фазами – А, АnВm и В. Из четырех возможных в этой системе фаз могут существовать три L, A, AnBm или L, B, AnBm. Химическое соединение устойчиво. Оно плавится при постоянной температуре.Химическое соединение можно рассматривать как однокомпонентную систему, тогда при плавлении с=0. Б) Диаграмма с неустойчивым химическим соединением Два компонента образуют неустойчивое химическое соединение, которое при нагреве до определенной температуры разлагается на жидкость и один из компонентов, т.е. не расплавляется полностью (рис.37). На линии DCF находятся в равновесии три фазы: жидкость концентрации D, кристаллы компонента В и кристаллы химического соединения AnBm.
а б Рис.37. Диаграмма состояния а) с твердым раствором на базе химического соединения, б) с неустойчивым химическим соединением (IV рода).
При нагреве неустойчивое химическое соединение распадается на жидкость концентрации D и кристаллы В. При охлаждении произойдет обратная реакция: LD+B®AnBm Реакция эта подобна перитектической. Жидкость реагирует с ранее выпавшими кристаллами, но образует не новый твердый раствор, как в случае с перитектической реакции, а химическое соединение.
|
||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 400; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.91.130 (0.007 с.) |


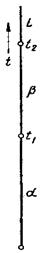




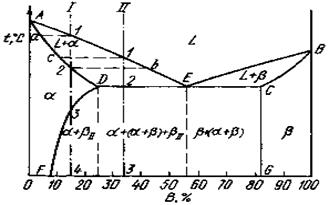
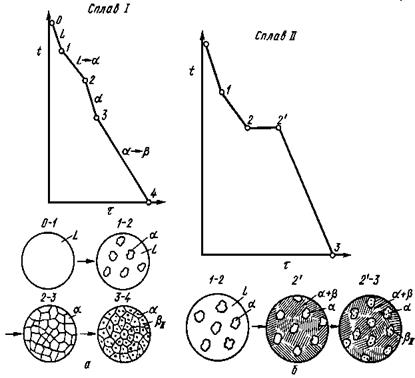
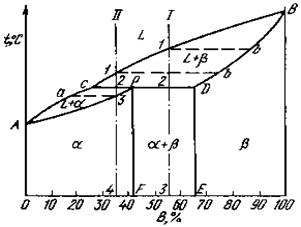 Рис.34. Диаграмма состояния с перитектикой (III рода)
Рис.34. Диаграмма состояния с перитектикой (III рода)





