
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства полисахаридовСодержание книги
Поиск на нашем сайте
Гидролиз: (C6H10O5)n + nH2O t,H2SO4 → nC6H12O6 глюкоза
49. Аминокислоты, состав, строение, номенклатура, химические свойства, получение и применение Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы. По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают насолеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной. α-аминокислоты являются амфотерными электролитами. Аминокислотами называются соединения, содержащие в молекуле амино- и карбоксильную группы. В зависимости от взаимного положения групп различают α-, β- и γ-аминокислоты. Одновременное присутствие в молекуле аминокислоты кислотной и основной групп приводит к внутримолекулярной нейтрализации. Учитывая это, свободные аминокислоты правильнее представлять в виде внутренних солей типа:
Это сказывается и на физических свойствах аминокислот: подобно обычным неорганическим солям, аминокислоты представляют собой кристаллические вещества, растворимые в воде и мало растворимые в органических растворителях. Они плавятся при высоких температурах и обычно при этом разлагаются. Переходить в парообразное состояние они не способны. Получение: ClCH2–COOH + 3NH3 → H2N–CH2–COONH4 + NH4Cl (р-ция Фишера); СH3–CHO ® CH3–CH(OH)–CN ® CH3–CH(NH2)–CN ® → H3–CH(NH2)–COOH (р-ция Зелинского). Химические свойства аминокислот в первом приближении являются суммой свойств имеющихся в их составе функций. Своеобразие аминокислот определяется, прежде всего, тем, что в них имеются две функции противоположного химического характера – аминогруппа со свойствами основания и карбоксильная группа со свойствами кислоты. Аминокислоты являются амфотерами.
1. H2N–CH2–COOH + HCl → HCl·H2N–CH2–COOH
2. H2N–CH2–COOH + NaOH→ H2N–CH2–COONa
Аминокислоты способны взаимодействовать друг с другом, образуя длинные цепи: H2NCH2COOH + HNНСН2COOH → H2NCH2COHNCH2COOH + H2O
50. Белки. Строение, физические и химические свойства, получение и применение. Белки́ (протеи́ны, полипепти́ды — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют ключевую роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле. Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии. Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами. Структуры белка Первичная – цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке. Вторичная – спираль. Удерживается водородными связями (слабыми). Третичная – глобула (шарик). Четыре типа связей: дисульфидная (серный мостик) сильная, остальные три (ионные, гидрофобные, водородные) – слабые. Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка. Четвертичная – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.
При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, оюразуя в конце цепочки превращения свмесь A-аминикослот. Такое расщепление называетсягидролизом белка. Гидролиз белка имеет большое биологическое значение: попадая в желудок и кишечник животного или человека, белок расщепляется под действием ферментов на аминокислоты. Образовавшиеся аминокислоты в дальнейшем под влиянием ферментов снова образуют белки, но уже характерные для данного организма!
51. Амины, состав, строение, номенклатура, химические свойства, получение и применение. Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы. По числу замещённых атомов водорода различают соответственно первичные (замещен один атом водорода), вторичные (замещены два атома водорода из трех) и третичные (замещены три атома водорода из трех) амины. Четвертичное аммониевое соединение вида [R4 N ]+ Cl - является органическим аналогом аммониевой соли. По характеру органической группы, связанной с азотом, различают алифатические CH 3- N <, ароматические C 6 H 5- N < и жирно-ароматические (содержат ароматический и алифатический радикалы) амины. По числу NH2-групп в молекуле амины делят на моно амины, ди амины, три амины и так далее. Номенклатура К названию органических остатков, связанных с азотом, добавляют слово «амин» при этом группы упоминают в алфавитном порядке: CH 3 NHC 3 H 7 — метилпропиламин, CH 3 N (C 6 H 5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода:
Для некоторых аминов используются тривиальные названия: C 6 H 5 NH 2 — анилин (систематическое название — фениламин). Химические свойства Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине. Алкиламины являются сильными основаниями, ариламины менее основны.
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 108; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.7.103 (0.008 с.) |


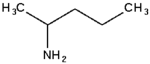 2-аминопентан
2-аминопентан


