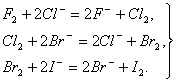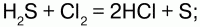Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства элементов подгруппы галогеновСодержание книги
Поиск на нашем сайте
Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами. Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением, которое у атомов фтора можно представить схемой
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р подуровень. У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а степень окисления всегда -1.Электронное строение атома хлора выражается схемой
У атома хлора один неспаренный электрон на 3р-подуровне и обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеется еще пять орбиталей 3d-подуровня, в которых могут разместиться 10 электронов. В возбужденном состоянии атома хлора электроны переходят с 3p - и 3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся в одной орбитали, увеличивает валентность на две единицы. Очевидно, хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1, 3, 5, 7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химическихреакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора и соединений. Водные растворы водородных соединений галогенов являются кислотами: НF — фтороводородная (плавиковая), НСl — хлороводородная (соляная), НВr — бромводородная, НI — йодоводородная. Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду. Фтор -самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются,выделяя большое количество теплоты, например:
2Аl + 3F2 = 2АlF3 + 2989 кДж, Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например: Н2 + F2 = 2НF + 547 кДж, Si + 2F2 = SiF4(г) + 1615 кДж. При нагревании фтор окисляет все другие галогены по схеме Hal2 + F2 = 2НаlF где Наl = Сl, Вr, I, причем в соединениях НаlF степени окисления хлора, брома и иода равны +1. Наконец, при облучении фтор реагирует даже с инертными (благородными) газами: Хе + F2 = ХеF2 + 152 кДж. Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер: 3F2 + ЗН2О = F2О↑ + 4НF + Н2О2. Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора: 2Аl + ЗСl2 = 2АlСl3(кр) + 1405 кДж, Si + 2Сl2 = SiCl4(Ж) + 662 кДж, Н2 + Сl2 = 2НСl(г)+185кДж. Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму: Cl2 + hv → 2Сl, Сl + Н2 → НСl + Н, Н + Cl2 → НСl + Сl, Сl + Н2 → НCl + Н и т.д. Возбуждение этой реакции происходит под действием фотонов (hv), которые вызывают диссоциацию молекул Сl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии. Реакция между Н2 и Сl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внес русский ученый, лауреат Нобелевской премии (1956 г) Н.Н. Семенов. Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами: СН3-СН3 + Сl2 → СН3-СН2Сl + НСl, СН2=СН2 + Сl2 → СН2Cl - СН2Сl. Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
Сl2 + 2НВr = 2НСl + Вr2, Сl2 + 2НI = 2НСl + I2, Сl2 + 2КВr = 2КСl + Вr2, а также обратимо реагирует с водой: Сl2 + Н2О Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой. Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала -1 (в НСl), у других +1 (в хлорноватистой кислоте НОСl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования. Хлор может таким же образом реагировать (диспропорционировать) с щелочами: Сl2 + 2NаОН = NаСl + NаСlO + Н2О (на холоде), ЗСl2 + 6КОН = 2КСl + КClO3 + ЗН2О (при нагревании). Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора. Для примера приведем реакции взаимодействия брома с кремнием и водородом: Si +2Вr2 = SiBr4(ж) + 433 кДж, Н2 + Вr2 = 2НВr(г) + 73 кДж. Являясь более «мягким» реагентом, бром находит широкое применение в органической химии. Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды». Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании,реакция является эндотермической и сильно обратимой: Н2 + I2 Таким образом, химическая активность галогенов последовательно уменьшается от фтора к йоду. Каждый галоген в ряду F - I может вытеснять последующий из его соединений с водородом или металлами, т.е.каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов:
1. 24. Общая характеристика подгруппы серы. Сера, характеристика свойств. Сероводород, его свойства. Оксиды серы и соответствующие им кислоты, их свойства. Подгруппа кислорода, или халькогенов – 6-я группа периодической системы Д.И. Менделле-ва, включающая следующие элементы: кислород – О;сера – S; селен – Se; теллур – Te; полоний – Po (радиоактивный элемент). Номер группы указывает на максимальную валентность элементов, стоящих в этой группе. Общая электронная формула халькогенов: ns2np4– на внешнем валентном уровне у всех элементов имеется 6 электронов, которые редко отдают и чаще принимают 2 недостающих до завершения уровня электрона. Наличие одинакового валентного уровня обуславливает химическое сходство халькогенов. Характерные степени окисления: -1; -2; 0; +1; +2; +4; +6. Кислород проявляет только -1 – в пероксидах; -2 – в оксидах; 0 – в свободном состоянии; +1 и +2 – во фторидах – О2F2, ОF2 т. к. у него нет d-под-уровня и электроны разъединяться не могут, и валентность всегда – 2; S – все, кроме +1 и -1. У серы появляется d-подуровень и электроны с 3р и с 3s в возбужденном состоянии могут разъединиться и уйти на d-подуровень. В невозбужденном состоянии валентность серы – 2 – в SО, 4 – в SО2, 6 – в SО3. Se +2; +4; +6, Te +4; +6, Po +2; -2. Валентности у селена, теллура и полония также 2, 4, 6. Значения степеней окисления отражены в электронном строении элементов: О – 2s22p4; S – 3s23p4; Se – 4s24p4; Te – 5s25p4; Po – 6s26p4. Сверху вниз, с нарастанием внешнего энергетического уровня закономерно изменяются физические и химические свойства халькогенов: радиус атома элементов увеличивается, энергия ионизации и сродства к электрону, а также электроотрицательность уменьшаются; уменьшаются неметаллические свойства, металлические увеличиваются (кислород, сера, селен, теллур – неметаллы), у полония имеется металлический блеск и электропроводимость. Водородные соединения халькогенов соответствуют формуле: H2R:– хальководороды. Водород в этих соединениях может быть замещен на ионы металлов. Степень окисления всех халькогенов в соединении с водородом -2 и валентность тоже 2. При растворении хальководородов в воде образуются соответствующие кислоты. Эти кислоты – восстановители. Сила этих кислот сверху вниз возрастает, т. к. уменьшается энергия связи и способствует активной диссоциации. Кислородные соединения халькогенов отвечают формуле: RО2 и RО3 – кислотные оксиды. При растворении этих оксидов в воде они образуют соответствующие кислоты: Н2RО3 и Н2RO4. В направлении сверху вниз сила этих кислот убывает. Н2RО3 – кислоты-восстановители, Н2RO4 – окислители.
Сера (S) в природе встречается в соединениях и свободном виде. Распространены и соединения серы, такие как свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S. Для получения серы основным источником служит железный колчедан (пирит) FeS2. Газовую серу получают из газов, образованных при коксовании и газификации угля. Сера не растворима в воде, но растворима в органических растворителя х. Является диэлектриком. Сера – неметалл с типичными для него свойствами. Взаимодействует со многими металлами непосредственно (медью, железом, цинком), выделяя при этом теплоту. Среди металлов лишь золото, платина и рутений не вступают в реакцию с серой. Взаимодействует также с большинством неметаллов, за исключением азота и йода. Химические свойства: 1) при нагревании сера реагирует с водородом, образуя сероводород: S + Н2 = H2S; 2) взаимодействуя с металлами, сера образует сульфиды: S + Fe = FeS; 2Al + 3S = Al2S3; Сера используется в большом количестве в народном хозяйстве. Серу используют для получения резины – при помощи серы происходит ее затвердевание (вулканизация). Серу используют для приготовления спичек, синей краски (ультрамарина), сероуглерода, серной кислоты.
Сероводород и сульфиды Сероводород (H2S) – бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также при разложении белков погибших растений и животных. Получение: 1) прямой синтез из элементов, при температуре 600 °C; 2) воздействием на сульфиды натрия и железа соляной кислотой. Физические свойства: сероводород тяжелее воздуха, очень ядовит. Сжижение его происходит при -60,8 °C, затвердение – при -85,7 °C. Легко воспламеняется на воздухе. Растворим в воде – при температуре 20 °C в 1 литре воды можно растворить 2,5 литра сероводорода, при этом образуется сероводородная кислота. Химические свойства: сероводород – сильный восстановитель, в зависимости от условий (температура, pH раствора, концентрация окислителя) при взаимодействии с окислителями он окисляется до диоксида серы или серной кислоты: 1) горит голубоватым пламенем на воздухе:
2) при высокой температуре разлагается:
3) вступает в реакцию с галогенами:
4) взаимодействует с окислителями:
5) серебро при взаимодействии с сероводородом темнеет:
Получение: основным методом производства серной кислоты из SO3 является контактный метод. Вначале получают диоксид серы SO2 (сжигание серы и др.). Самый распространенный способ получения – обжиг серного колчедана FeS2, затем диоксид серы SO2 окисляют в триоксид серы SO3 контактным методом Физические свойства: Серная кислота – бесцветная вязкая жидкость, имеющая температуру плавления 10 °C, температура кипения 296 °C (с разложением на H2O и SO3). Серная кислота – сильная кислота. Концентрированная серная кислота в большом количестве поглощает пары воды, поэтому ее используют для осушения газов. ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ. Изменяет цвет индикатора:
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 151; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.192.173 (0.011 с.) |

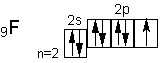

 НСl + НСlO - 25 кДж.
НСl + НСlO - 25 кДж.