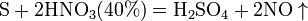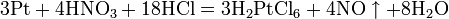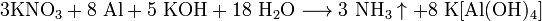Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Разбавленная растворяет металлы, стоящие в ряду напряжений до водорода.Содержание книги
Поиск на нашем сайте
2 Качественная реакция При взаимодействии с солями Ва выпадает белый кристаллический осадок:
2. Концентрированная серная кислота является сильным окислителем. Окислительно-восстановительные реакции требуют нагревания, а продуктом реакции в основном является SO2.
2. С металлами вступает в реакцию по-разному в зависимости от концентрации. Разбавленная серная кислота взаимодействует со всеми металлами, стоящими в ряду напряжений до водорода. Концентрированная серная кислота окисляет все металлы, стоящие в ряду напряжений, и серебро в том числе. Концентрированная при обычной температуре со многими металлами не реагирует, поэтому безводную При нагревании взаимодействует почти со всеми металлами кроме Pb, Au.
3. Разбавленная серная кислота взаимодействует с основаниями, основными и амфотерными оксидами, солями. Серная кислота образует два вида солей: средние (сульфаты) и кислые (гидросульфаты). Применение: серная кислота относится к главным продуктам химической промышленности. Ее используют для изготовления фосфорных и азотных удобрений, искусственных волокон, моющих средств, взрывчатых веществ, лекарственных препаратов. С ее помощью получают другие кислоты, сульфаты, очищают нефтепродукты, применяют как электролит в свинцовых аккумуляторах, подготавливают поверхность металлов для гальванических покрытий. 25. Общая характеристика элементов подгруппы азота. Аммиак, его свойства. Азотная кислота, физико-химические свойства. Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi). Общая электронная формула элементов подгруппы азота: ns2np3 – на внешнем энергетическом уровне эти элементы содержат пять валентных электронов, на что указывает номер группы – два электрона на s-подуровне и три не-спаренных электрона на р-подуровне. Это р-эле-менты. У каждого последующего нижестоящего атома нарастает энергетический уровень (N – 2 s2 2p3; P – 3 s2 3p3; As – 4 s2 4p3; Sb – 5 s2 5p3; Bi – 6 s2 6p3), в связи с чем увеличивается радиус атома, уменьшается энергия ионизации, энергия сродства к электрону, электроотрицательность, ослабевают неметаллические свойства – усиливаются металлические. Характерны следующие степени окисления: N – +1, +2, +3, +4, +5, 0, -1, -3, -5; P – от +1 до +5 (кроме +2), 0, -2, -3; все остальные: +3, +5, -3. Характерные валентности: 3, 4, 5. Азот пятивалентным быть не может – максимальная его валентность равна четырем, т. к. наивысшая валентность равна числу возможных квантовых ячеек на внешнем уровне – у азота их четыре (одна s– и три р-орбитали), следовательно, число ковалентных связей тоже четыре. Итак, азот в невозбужденном состоянии имеет валентность три, а в возбужденном (при переходе электронов с s-подуровня) – четыре. Аммиак Физические свойства: аммиак (NH3) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха; при охлаждении до -33,4 °C и нормальном давлении превращается в прозрачную жидкость, при 77,8 °C затвердевает. Массовая доля аммиака в концентрированном растворе – 25 %. Раствор NH3 в воде – аммиачная вода или нашатырный спирт. Медицинский нашатырный спирт – 10 %. При низкой температуре образует в растворе кристаллогидрат NH3* Н2О. Строение молекулы: характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода. Молекула имеет форму правильной пирамиды, в вершине которой стоят атомы азота, а в углах – водорода. Химические свойства: 1) при растворении NH3 в воде образуются гидратированные молекулы аммиака и частично ионы аммония – NH4+ и ОН-ионы – водный раствор аммиака имеет слабощелочную реакцию. 2) NH3 взаимодействует с кислотами: NH3 + Н2SO4 = NH4НSO4; 3) аммиак – сильный восстановитель. Из СuО при нагревании восстанавливает Сu: 3СuО + 2NH3 = Сu + N2 + 3Н2О; 4) в кислороде NH3 горит желтым пламенем: 4NH3 + 3О2 = 2N2 + 6Н2О; Используется хлорид аммония (NH4Cl) – нашатырь.
Аммиак – NO переходит в NO2, который с водой в присутствии кислорода воздуха дает азотную кислоту.
Катализатор – платиновые сплавы. Получаемая HNO3 не более 60 %. При необходимости ее концентрируют. Промышленностью выпускается разбавленная HNO3 (47–45 %), а концентрированная HNO3 (98–97 %). Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную – в цистернах из кислотоупорной стали.
Азо́тная кислота́ (HNO3), — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации смоноклинной и ромбической решётками. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Химические свойства Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией). Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3 как сильная одноосновная кислота взаимодействует: а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует: а) с металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3. Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот: увеличение концентрации кислоты Продукты взаимодействия железа с HNO3 разной концентрации С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой. Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию. Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором ихлоридом нитрозила:
Нитраты HNO3 — сильная кислота. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом: а) нитраты металлов, стоящих в ряду напряжений левее магния: 2NaNO3 = 2NaNO2 + O2 б) нитраты металлов, расположенных в ряду напряжений между магнием и медью: 4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2 в) нитраты металлов, расположенных в ряду напряжений правее ртути: 2AgNO3 = 2Ag + 2NO2 + O2 г) нитрат аммония: NH4NO3 = N2O + 2H2O Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии нитраты — сильные окислители, например: Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O — при сплавлении твердых веществ. Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно. С азотной кислотой не реагируют стекло, фторопласт-4.
26 Общая характеристика элементов подгруппы углерода. Оксиды углерода. Угольная кислота, физико-химические свойства. В подгруппу углерода входят углерод, кремний, германий, олово и свинец. Это р-элементы IV группы периодической системы Д.И. Менделеева. Их атомы на внешнем уровне содержат по четыре электрона ns2np2, чем объясняется сходство их химических свойств. Электронное строение внешних уровней атомов первых двух элементов подгруппы можно представить так
В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные орбитали, то при переходе в возбужденное состояние распаривают электроны s-подуровней (показано пунктирными стрелками). В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2.Степень окисления -4 в последовательности C – Pb становится все менее характерной.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 129; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.45.223 (0.01 с.) |


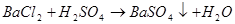

 можно хранить в железной таре и перевозить в цистернах.
можно хранить в железной таре и перевозить в цистернах.
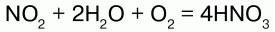


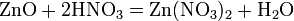
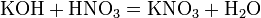



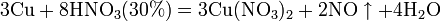

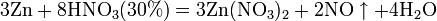

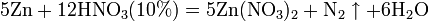

 увеличение активности металла
увеличение активности металла