Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос 2 Кислоты, номенклатура, классификация, получение, свойстваСодержание книги
Поиск на нашем сайте
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. Классификация кислот 1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот: n = 1 одноосновная HCl n = 2 двухосновная H2S n = 3 трехосновная H3PO4 Физические свойства кислот Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д. Способы получения кислот бескислородные HCl, HBr, HI, HF, H2S кислородсодержащие HNO3, H2SO4 и другие Получение:
Свойства кислот: 1) Взаимодействуют с металлами:
Металлы, стоящие в ряду стандартных электродных потенциалов правее водорода, из кислот его не вытесняют. Водород не выделяется и при взаимодействии металлов с концентрированными азотной и серной кислотами. 2) С основными оксидами:
3) С основаниями:
4) С солями:
5. Реагируют с солями слабых, летучих кислот - если образуется кислота, выпадающая в осадок или выделяется газ: Каждая предыдущая кислота может вытеснить из соли последующую 6. Разложение кислородсодержащих кислот при нагревании КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА 3 Гидроксиды, классификация, получение, свойства. Основаниями (основными гидроксидами) с позиции теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов ОН-. По современной номенклатуре их принято называть гидроксидами элементов с указанием, если необходимо, валентности элемента КОН – гидроксид калия, гидроксид натрия NaOH, гидроксид кальция Ca(OH)2, гидроксид хрома (II) – Cr(OH)2, гидроксид хрома (III) – Cr(OH)3. Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами - Li, Na, K, Cs, Rb, Fr, Ca, Sr, Ba и поэтому называемые щелочами) и нерастворимые в воде. По числу гидроксильных групп (кислотность), способных замещаться на кислотный остаток, различают: - однокислотные основания – KOH, NaOH; - двухкислотные основания – Fe(OH)2, Ba(OH)2; - трехкислотные основания – Al(OH)3, Fe(OH)3.
Получение:
2) Взаимодействие оксидов с водой:
3) Взаимодействие щелочей с солями:
Свойства:
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 99; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.36.215 (0.009 с.) |


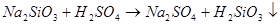
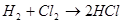


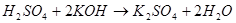

 1) Взаимодействие активных металлов с водой:
1) Взаимодействие активных металлов с водой: