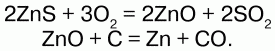Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные способы получения металловСодержание книги
Поиск на нашем сайте
Большое количество металлов находится в природе в виде соединений. Самородными металлами называются те, которые встречаются в свободном состоянии (золото, платина, ртуть, олово). Золото добывают либо отделяя механически от примесей, либо извлекая из породы при помощи реагентов. Остальные металлы получают с помощью химической обработки их соединений. Руды – горные породы и минералы, имеющие в составе соединения металлов, пригодные для получения их промышленным способом (оксиды, сульфиды и карбонаты металлов). Способы получения металлов: 1) одним из главных способов получения металлов из руд основан на восстановлении их оксидов углем: Cu2O + C = 2Cu + CO?; 2) производят выплавку чугуна из железных руд, получение олова из оловянного камня SnO2 и восстановление других металлов из оксидов; 3) для получения металлов из сернистых руд, последние вначале переводят в сернистые соединения с помощью обжигания в специальных печах:
Руду, представляющую собой соль угольной кислоты, можно сразу восстанавливать при помощи угля: ZnCO3 = ZnO + CO2. 29. Коррозия металлов. Способы защиты металлов от коррозии. Коррозия металлов (corrosio – разъедание) – физико-химическая реакция металлов и сплавов с окружающей средой, в результате чего они теряют свои свойства. В основе коррозии лежит реакция на границе раздела фаз между материалом и средой: 3Fe+2О2=Fe3O4. По условиям протекания коррозия подразделяется на: 1) контактную; 2) щелевую; 3) по ватерлинии; 4) в зонах обрызгивания; 5) в зонах переменного смачивания; 6) протекающую по конденсации кислых паров; 7) радиационную; 8) происходящую при теплоотдаче; 9) образованную блуждающими токами. Типы коррозии: Химическая или газовая коррозия (металлы и сплавы разрушаются, взаимодействуя с кислородом, водородом и другими газами при отсутствии влаги). Электрохимическая коррозия (возникновение контакта металла или сплава в растворе электролита). Химическая коррозия. Представлена процессами окисления металла и восстановления агента коррозии (чаще всего – кислород): 2Ме + О2 = 2МеО. Важную роль играет газовая коррозия – коррозия металлов при высоких температурах в сухих газах (продукты сгорания топлива и др.). Факторы, воздействующие на скорость газовой коррозии: 1) природа металла (сплава); 2) состав газовой среды; 3) механические свойства образующихся продуктов коррозии (оксидных пленок); 4) температура. Электрохимическая коррозия более распространена, включает в себя процессы окисления металла и восстановления коррозийного агента, протекающие раздельно в электролитной среде (растворы солей, кислот, почва и др.). Процесс ржавления железа: 2Fe + 2H2O + O2 = 2Fe2++ 4OH-. В углеродистых сталях нередко возникают гальванические элементы «катод—анод». Это происходит в связи с дифференциацией поверхностей сталей на участки, имеющие различные электронные потенциалы. Защита металлов от коррозии Защита металлов и сплавов от коррозии в агрессивных средах основывается на: 1) повышении коррозионной стойкости самого материала; 2) снижении агрессивности среды; 3) предотвращении контакта материала со средой с помощью изолирующего покрытия; 4) регулировании электродного потенциала защищаемого изделия в данной среде. Существуют методы, используемые для защиты от электрохимической коррозии: 1) использование химически стойких сплавов; 2) защита покрытием поверхности металла или сплава; 3) снижение активности коррозийной среды; 4) электрохимические методы. Металлические покрытия – хром, никель, цинк, кадмий, алюминий, олово и др. Их наносят, используя методы гальванотехники. Неметаллические покрытия – лаки, краски, эмали, фенолформальдегидные смолы и др.
30. Щелочные металлы, физические и химические свойства, получение, применение. Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы)[1]: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами. В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: ихэлектронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства.В большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов). Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 97; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.164.100 (0.007 с.) |