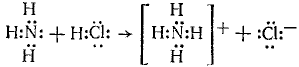Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая связь, в основе которой лежит электростатическое Взаимодействие ионов, называется ионной.Содержание книги
Поиск на нашем сайте
Металлическая связь – химическая связь, основанная на обобществлении валентных электронов, принадлежащая практически всем атомам в кристалле онами. Донорно-акцепторная связь (координационная связь, семиполярная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Донорно-акцепторная связь образуется часто при комплексообразовании за счет свободной пары электронов, принадлежавшей (до образования связи) только одному атому (донору). Донорно-акцепторная связь отличается от обычной ковалентной только происхождением связевых электронов. Реакция аммиака с кислотой состоит в присоединении протона, отдаваемого кислотой, к неподеленным электронам азота:
В ионе NH4+ все четыре связи азота с водородом равноценны, хотя отличаются происхождением. Донорами могут быть атомы азота, кислорода, фосфора, серы и др. Роль акцепторов могут выполнять протон, а также атомы с незаполненным октетом, напр. атомы элементов III группы таблицы Д. И. Менделеева, а также атомы-комплексообразователи, имеющие незаполненные энергетические ячейки в валентном электронном слое
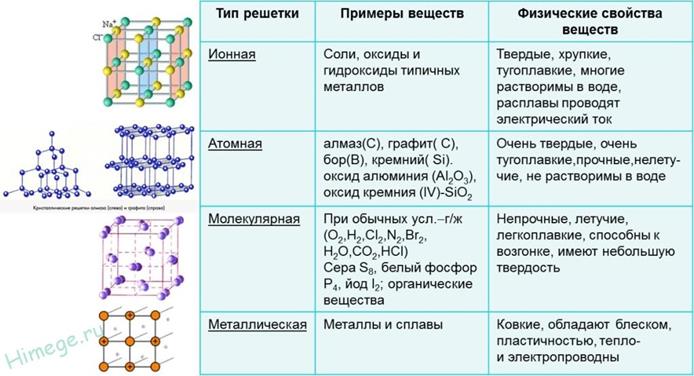
11. Типы кристаллических решеток. Вещества молекулярного и немолекулярного строения. Под строением вещества понимают, из каких частиц (молекул, ионов, атомов) построена его кристаллическая решетка. Вещества по строению: Молекулярные в-ва-это вещества, мельчайшими структурными частицами которых являются молекулы. Немолекулярные вещества- это в-ва, мельчайшими структурными единицами являются атомы или ионы. \
12. Дисперсные системы, их классификация. Дисперсная фаза и дисперсионная среда. Понятие о коллоидах. Гели. Дисперсные системы – это системы, в которых мелкие частицы вещества, или дисперсная фаза, распределены в однородной среде (жидкость, газ, кристалл), или дисперсионной среде.
Химия дисперсных систем изучает поведение вещества в сильно раздробленном, высокодисперсном состоянии, характеризующемся очень высоким отношением общей площади поверхности всех частиц к их общему объему или массе (степень дисперсности). От названия коллоидных систем произошло название отдельной области химии – коллоидной. «Коллоидная химия» – традиционное название химии дисперсных систем и поверхностных явлений. Раньше коллоидами называли клееподобные вещества, теперь это высокодисперсные системы с сильно развитой поверхностью раздела фаз., Под выражением «коллоидный раствор» име.т в виду высокодисперсное состояние вещества в воде в качестве дисперсионной среды. Важнейшая особенность дисперсного состояния вещества состоит в том, что энергия системы главным образом сосредоточена на поверхности раздела фаз. При диспергировании, или измельчении, вещества происходит значительное увеличение площади поверхности частиц (при постоянном суммарном их объеме). При этом энергия, затрачиваемая на измельчение и на преодоление сил притяжения между образующимися частицами, переходит в энергию поверхностного слоя – поверхностную энергию. Чем выше степень измельчения, тем больше поверхностная энергия. Поэтому область химии дисперсных систем (и коллоидных растворов) считают химией поверхностных явлений. Коллоидные частицы настолько малы (содержат 103–109 атомов), что не задерживаются обычными фильтрами, не видны в обычный микроскоп, не оседают под действием силы тяжести. Их устойчивость со временем снижается, т.е. они подвержены «старению». Дисперсные системы термодинамически неустойчивы и стремятся к состоянию с наименьшей энергией, когда поверхностная энергия частиц становится минимальной. Это достигается за счет уменьшения общей площади поверхности при укрупнении частиц (что может также происходить при адсорбции на поверхности частиц других веществ). Свойства вещества в раздробленном, или дисперсном, состоянии значительно отличаются от свойств того же вещества, находящегося в недисперсном состоянии, т.е. в виде куска твердого тела или некоторого объема жидкости.
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.82.60 (0.007 с.) |