Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы получения и химические свойства спиртов.Содержание книги
Поиск на нашем сайте
ПОЛУЧЕНИЕ.
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ.
Главное промышленное применение метилового спирта – получение формальдегида. Он используется также для синтеза метилирующих средств (хлористого метила, диметилсульфата), получения уксусной кислоты. Также используется как растворитель. Этиловый спирт является сырьем для получения синтетического каучука. Также он используется как растворитель для экстракции и кристаллизации, для изготовления лаков и красок, для консервирования анатомических препаратов, как дезинфицирующее средство, для изготовления лекарственных веществ, в парфюмерной промышленности для изготовления одеколона и духов. Большие количества спирта расходуются для синтеза эфира, сложных эфиров органических кислот, хлороформа, йодоформа и др. Пропиловые, бутиловые и амиловые спирты используются в качестве растворителей. Высшие жирные спирты применяются в качестве ПАВ: антииспарителей (защита водоемов), пенообразователей и др. Диэфиры на основе высших жирных спиртов – хорошие смазочные масла для авиационных двигателей. В большом количестве высшие жирные спирты используются для получения синтетических моющих средств. На основе высших жирных спиртов получают четвертичные аммониевые соли, микродобавки которых в воду обеззараживают ее. Циклогексанол используется в промышленности для получения синтетических волокон капрон и найлон.
43. Фенолы, особенности строения. Физические и химические свойства, получение и применение фенолов. Фенолы - гидроксилсодержащие ароматические соединения, в молекулах которых гидроксил связан непосредственно с углеродным атомом бензольного ядра. Общая формула: Ar–OH. Гидроксогруппа и бензольное ядро оказывают большое влияние друг на друга: неподеленная пара кислорода вступает в сопряжение с π - электронами ядра (1). В результате электронная плотность переходит частично на связь С–О, увеличивая при этом электронную плотность в о - и п -положениях в ядре. Электронная пара связи О–Н сильнее притягивается к атому кислорода, способствуя тем самым созданию положительного заряда на атоме Н гдроксогруппы и отщеплению его в виде протона (2). В результате этого фенолы проявляет более сильный кислотный характер по сравнению со спиртами: 1.
2.
Физические свойства Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком! Свойства гидроксила Фенол > Вода > Cпирт 1. C6H5ОН + NaOH → C6H5ОNa + H2O 2. 2C6H5ОН + 2Na → 2C6H5ОNa + H2 3. C6H5ОNa + CO2 + H2O → C6H5ОН + NaHCO3 4. Ar–OH + RX → Ar–O–X + NaX 5. C6H5ОН + Cl–CO–CH3 → C6H5–О–CO–CH3 + HCl 6. C6H5ОН + Zn → C6H6 + ZnO Свойства бензольного ядра 1. C6H5ОН + 3Br2 → C6H2Br3OH + 3HBr 2. C6H5ОН + Cl2 → о- C6H4ClОН + п- C6H4ClОН 3. C6H5ОН +3HNO3 (к) → C6H2(NO2)3ОН + 3H2O 4. C6H5ОН + HNO3(p) → о- C6H4NO2ОН + п- C6H4NO2ОН 5. C6H5ОН + CH2C(CH3)CH3 → (CH3)3C–C6H4ỢOH Фенол применяется для производства красителей пикриновой кислоты и особенно для получения пластмасс – фенолоформальдегидных смол. Растворы фенола используются для дезинфекции.
44. Альдегиды и кетоны. Гомологические ряды. Изомерия и номенклатура. Химическое и электронное строение, реакции нуклеофильного присоединения водорода,галогеноводородов. Реакции поликонденсации Соединения, в молекулах которых карбонильная группа связана с одним органическим радикалом и с атомом водорода называются альдегидами. Соединения, в которых карбонильная группа связана с двумя органическими радикалами, называются кетонами. В функциональной группе альдегидов и кетонов связь между углеродом и кислородом двойная. Углеродный атом карбонильной группы находится в состоянии sp2-гибридизации и его конфигурация является плоской. В отличие от двойной С=С связи, вследствие большей ЭО кислорода по сравнению с углеродом, связь поляризована за счет смещения электронной плотности π-связи к кислороду: >Сδ+ = Оδ– Алифатические альдегиды называют по самой длинной углеродной цепи, прибавляя к названию алифатического углеводорода окончание -аль. Наличие в соединении двух альдегидных групп обозначается окончанием -диаль. Нумерацию цепи начинают от углеродного атома, принадлежащего альдегидной группе. В названии номер при альдегидной группе, как правило, не ставят. Полярность сказывается на физических и химических свойствах. Многие альдегиды и кетоны хорошо растворимы в воде. Низшие альдегиды обладают резким запахом, многие высшие альдегиды и кетоны обладают приятным запахом и используются в парфюмерии. 1. R–CHO + 2H → R–CH2–OH R’R”C=O + 2H → R’R”CH–OH 5. R–COH + Ag2O → R–COOH + 2Ag Формальдегид: в промышленности формальдегид получают из метилового спирта. Пары спирта вместе с воздухом пропускают над раскаленной медью: 2СН3ОН + 2О2 → 2СН2О + 2H2O К-р: Cu Другим важным способом является неполное окисление метана: СН4 + О2 →СН2О + H2O к-р: t=400° Используется для различных синтезов. Обладает токсичностью для микроорганизмов и применяется как дезинфицирующее средство. Используется в кожевенной промышленности, для хранения медицинских препаратов и т. д. Ацетальдегид: в промышленности получают из ацетилена по реакции Кучерова и окислением этанола. Современным способом получения является каталитическое окисление этилена: СН2=СН2 + ⅛О2 → СН3–СНО К-р: PdCl2 Используется для получения уксусной кислоты, этилацетата, “сухого спирта” (метальдегида) и этилового спирта. Ацетон: в промышленности получают каталитической кетонизацией уксусной кислоты, дегидрированием изопропилового спирта, прямым окислением пропилена: СН2=СН–СН3 + ⅛О2 → СН3–СО–СН3 К-р: PdCl2, Cu2Cl2 Ацетон применяется как растворитель для лаков, кинопленки, для получения искусственного ацетатного волокна, ацетилена, а также во многих синтеза
45. Карбоновые кислоты, состав, строение, номенклатура, химические свойства, получение и применение Карбоновыми кислотами называются соединения, содержащие в молекуле группу –СООН, носящую название карбоксильной, происходящее от названий
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 145; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.170.38 (0.009 с.) |


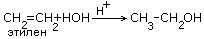

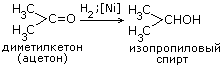
 2C2H5OH+2CO2
2C2H5OH+2CO2
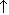
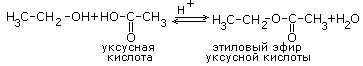

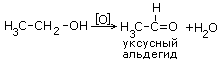 При окислении вторичных спиртов образуются кетоны
При окислении вторичных спиртов образуются кетоны