
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спектрохимический ряд лигандовСодержание книги
Поиск на нашем сайте
I‾, Cl‾, F‾, OH‾, H2O, CNS‾, NH3, NO2‾, CN‾ Слабые лиганды Сильные лиганды
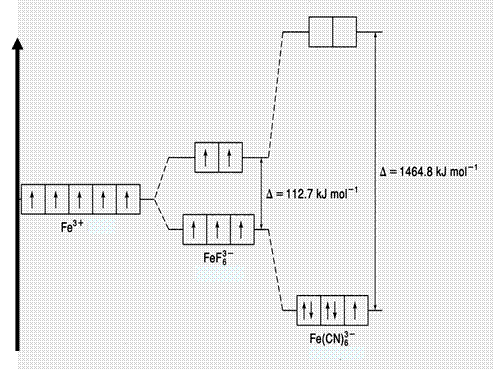
Увеличение энергии расщепления ∆ В поле слабых лигандов энергия расщепления (∆) не велика, поэтому распределение электронов на d-орбиталях соответствует правилу Хунда.В поле сильных лигандов энергия расщепления (∆) имеет большое значение, вследствие чего первыми заполняются d-орбитали нижнего подуровня (распределение электронов происходит против правила Хунда). Рассмотрим строение комплексных ионов железа [FeF6]3‾ и [Fe(CN)6]3‾. В обоих соединениях степень окисления железа равна + 3, а его координационное число равно 6, так как железо связано с шестью монодентантными лигандами. Электронная конфигурация иона Fe3+описывается формулой 4s03d5. Оба комплексных иона имеют октаэдрическую конфигурацию (табл.2), что обуславливает одинаковый характер расщепления d-орбиталей. Фторид-ион (F-) является «слабым лигандом» (∆ = 112,7 кДж/моль), поэтому распределение электронов катиона Fe3+ происходит в соответствии с правилом Хунда. Цианид-ион (CN-) является «сильным лигандом» (∆ = 1464,8 кДж/моль), поэтому распределение электронов катиона Fe3+ происходит против правила Хунда. Ион [FeF6]3- парамагнитен, так как содержит неспаренные электроны на внешнем уровне. Такие комплексы называются высокоспиновыми. Ион [Fe(СN)6]3- диамагнитен, так как содержит лишь один неспаренный электрон. Такие комплексы называются низкоспиновыми ((рисунок 57).
Рисунок 57 — Энергетические диаграммы комплексных ионов железа
13.3. Металло-лигандное равновесие в растворах.
Комплексные соединения можно разделить на две группы: электролиты и неэлектролиты. Комплексы-электролиты содержат ионы внешней сферы, а у комплексов-неэлектролитов они отсутствуют. Электролитами являются комплексные кислоты (H2[PtCl4]), комплексные основания ([Ag(NH3)2]OH) и комплексные соли (K4[Fe(CN)6]). Примером комплексного неэлектролита может служить [Pt(NH3)2Cl2]. Рассматривая диссоциацию комплексных электролитов,различают первичную (необратимую) стадию: K4[Fe(CN)6] → 4 K+ + [Fe(CN)6]4‾ и вторичную (обратимую) диссоциацию комплексных ионов: [Fe(CN)6]4‾ Константа равновесия, описывающая вторичную диссоциацию комплексов, называется константой нестойкости (Кн). В соответствии с законом действующих масс, Kн для приведенного иона можно рассчитать следующим образом:
Чем меньше Кн, тем устойчивее комплексное соединение:
[Ag(NO2)2]‾ [Ag(NH3)2]+ [Ag(CN)2]‾ 1,3∙10‾3 6,8·10‾8 1,0∙10‾21
увеличение устойчивости комплексных ионов Устойчивость комплексов можно охарактеризовать при помощи константы устойчивости (Ку):
Причины устойчивости комплексных соединений кроются в их строении. Так, чем меньше ионный радиус комплексообразователя и больше его заряд, тем сильнее притяжение лигандов и устойчивее комплекс. Вот почему увеличение комплексообразующей способности металлов наблюдается в следующем ряду: s-металлы < p- металлы < d-металлы. d-Элементы, имеющие маленькие ионные радиусы и большие электрические заряды ионов, являются лучшими комплексообразователями. Другим фактором, влияющим на устойчивость комплексных соединений, является дентантность их лигандов. Доказано, что чем выше дентантность лиганда, тем устойчивее комплекс: Кн [Co(NH3)4]2+ 1,0·10‾5 [Co(Гли)2] 3,3∙10‾9 [CoY]2‾ 1,0∙10‾16 Самыми устойчивыми комплексными соединениями являются хелатные комплексы. Это явление получило название эффекта хелатирования.
Биологическая роль КС
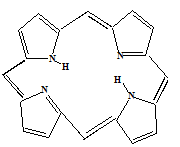
В организме человека все металлы, кроме щелочных и, частично, щелочноземельных, находятся в виде прочных хелатных комплексов с биолигандами: белками, аминокислотами, витаминами, гормонами и другими биоактивными соединениями.Важнейшими являются комплексы с белками (рисунок 58). К ним относятся многочисленные металлоферменты, а так же гемоглобин (комплекс железа с порфином) и хлорофилл (комплекс магния).
Рисунок 58— Порфин – это биолиганд, входящий в состав гемоглобина, хлорофилла, цитохромов С и некоторых других биосоединений
Сбалансированные потоки металлов и лигандов в биосистемах обуславливают металло-лигандный гомеостаз. Его нарушение приводит к различным заболеваниям. Например, при недостатке железа развивается анемия, при его избытке — сидероз. По данным Всемирной организации здравоохранения (ВОЗ) дефицит железа в организме человека является одной из наиболее серьезных проблем современности. На земном шаре от дефицита железа страдает 4-5 миллиардов человек (66-80% населения Земли). Недостаток железа — один из десяти глобальных факторов риска, являющийся причиной смерти 800 000 человек в год. Недостаток кальция приводит к остеопорозу, а его избыток в организме человека способствует развитию катаракты, атеросклероза, а также обызвествлению костной ткани. Для коррекции металло-лигандного гомеостаза используются: · комплексоны, связывающие токсичные металлы, и выводящие их из организма человека; · комплексные соединения. Так, комплексы платины (например [Pt(NH3)2Cl2]), применяются как противоопухолевые препараты. Комплексы золота (Na3[Au(S2O3)2]) используются для лечения артритов и туберкулеза. Тетацин находит широкое применение при отравлениях тяжелыми металлами. Строение, свойства и биологическая роль КС металлов с биолигандами является объектом изучения бионеорганической химии, возникшей в середине 50-х годов, на стыке неорганической химии, биологии и медицины.Достижения бионеорганической химии широко внедряются в медицину.
Лекция 14 Химия биогенных элементов
план 14.1. Основы биогеохимии. 14.2. Химия s-элементов. 14.3. Химия d-элементов. 14.4. Химия p-элементов.
Основы биогеохимии
Биогеохимия ― это наука, изучающая распределение химических элементов и их миграцию в биосфере. Основным вопросом биогеохимии является вопрос о взаимосвязи живого и неживого вещества.Становление биогеохимии как науки произошло в 30-е годы XX века. Ее основоположником является академик В.И. Вернадский. Биосфера ― это единственная область Земли, занятая жизнью. Она включает в себя литосферу, гидросферу и атмосферу, состоящую из тропосферы и стратосферы. Анализируя содержание элементов в земной коре и в живых организмах, Вернадский пришел к выводу, что качественный состав этих объектов близок. Он предполагал, что в живом организме когда-нибудь будут найдены все элементы ПС, обнаруженные в неживой природе. Однако простой взаимосвязи между содержанием элементов в живой и неживой природе не существует. 98 % земной коры составляют 8 химических элементов: О, Si, Al, Fе, Са, Na, К, Mg. В живом организме преобладают 6 элементов: С, H, О, N, P, S, на которые приходится 97,4 % массы тела. В земной коре преобладают металлы, а в живых организмах ― неметаллы. Все живые вещества образуют биомассу, причем человечество составляет лишь небольшую часть ее. В разных геосферах химические элементы распределены неравномерно (таблица 15).
Таблица 15 ― Массовая доля некоторых элементов в геосферах Земли
Из основных элементов биомассы только кислород и кальций широко представлены в земной коре. Такие элементы как кремний, алюминий и железо, находящиеся в земной коре в наибольших количествах, в биомассе представлены в невысоких концентрациях. Согласно теории А.П. Виноградова, живые организмы легко накапливают те химические элементы, которые образуют газы и пары атмосферы или водорастворимые соединения с главными ионами гидросферы (H+, OH‾, HCO3‾, CO32‾, I‾, SO42‾, PO43‾). Например,С ― макроэлемент, т.к. образуемые им оксиды СО и СО2 ― газы; Si ― микроэлемент, т.к. SiO2 ― нерастворимое в воде твердое вещество. Биогенными называются химические элементы в той или иной форме входящие в состав биомассы и выполняющие в ней определенные жизненные функции. К важнейшим биогенным элементам относятся: · 6 неметаллов-органогенов: C, O, H, N, P, S; · 10 биометаллов (металлов жизни): Na, K, Mg, Ca (s-элементы) и Fe, Co, Cu, Zn, Mn, Mo (d-элементы). По содержанию в биомассе химические элементы делятся на: · макроэлементы (более 10‾2 %): неметаллы-органогены и Cl, а так же биометаллы, относящиеся к s-блоку; · микроэлементы (10‾5-10‾3 %): биометаллы, относящиеся к d-блоку, а так же Ni, Cr, Si, B и др.; · ультрамикроэлементы (менее 10‾5 %): Hg, Au и др. Установлена взаимосвязь между содержанием элемента в организме и его положением в Периодической системе химических элементов. Например, в подгруппах сверху вниз происходит увеличение токсичности химических элементов и их соединений и, как следствие, уменьшение содержания в биомассе (таблица 16).
Таблица 16 ― Наиболее токсичные металлы
* Выделены металлы, признанные остротоксичными
На токсичность химического элемента влияет степень его окисления в соединении. Чем выше степень окисления элемента, тем выше его токсичность. Так, ионы хрома Сr3+ являются малотоксичными, а анионы СrO42- и Cr2O72-, содержащие Cr6+, характеризуются высокой токсичностью. А.П. Виноградов сформулировал понятие о биогеохимической провинции. Это часть биосферы, характеризующаяся экстремальными геохимическими условиями и определенными постоянными реакциями организмов на них (эндемические заболевания, возникновение мутантов, уродства и др.). Например, Белорусское Полесье характеризуется крайне низким содержанием йода, что приводит к массовым случаям заболевания щитовидной железы (эндемический зоб). Спектр йоддефицитных заболеваний весьма широк. Дефицит тиреоидных гормонов у плода приводит к снижению умственного развития, вплоть до кретинизма. В результате исследований выяснилось, что от йодного дефицита страдает не только мозг ребенка, но и его слух, речь, зрительная память. Биогеохимия явилась фундаментом для современной экологической химии, изучающей вопросы, связанные с характеристикой основных химических токсикантов, методами борьбы с ними, изысканием новых экологически чистых источников энергии.
Химия s-элементов
Исходя из современной квантово-механической интерпретации периодической системы, классификация химических элементов производится в соответствии с их электронной конфигурацией. Она основана на характере заполнения орбиталей электронами. В соответствии с этим принципом все элементы делятся на s-, p-, d- и f - блоки или семейства. Элементы с одинаковым электронным строением внешнего энергетического уровня называются электронными аналогами. Общность электронного строения обуславливает общность их свойств. Электронными аналогами являются элементы, относящиеся к одной подгруппе. Элементы второго периода являются неполными электронными аналогами в своих подгруппах, так как не содержат валентных d-орбиталей. К s-блоку относятся химические элементы с электронной формулой: nsx, где х = 1, 2 (таблица 17). Различают s1-элементы (щелочные металлы и водород) и s2-элементы (Be, Mg, щелочноземельные металлы Ca, Sr, Ba, Ra и гелий) (таблица 18).
Таблица 17 ― Физико-химические характеристики s1-элементов
Таблица 18 ― Физико-химические характеристики s2-элементов
Элементы s-блока ― это металлы (исключение составляют H и He). Самыми активными являются щелочные металлы, легко отдающие валентный электрон и превращающиеся в устойчивые однозарядные катионы: Me – е- → Me+. Их высокая металличность обусловлена большими атомными радиусами и лишь одним валентным электроном на внешнем уровне. s2-Элементы уступают им по металличности, так как имеют меньшие радиусы и большее число валентных электронов. В подгруппах s-элементов сверху вниз металличность атомов усиливается, что обусловлено увеличением атомных радиусов и уменьшением энергии ионизации. В своих соединениях s-металлы проявляют степени окисления +1 (щелочные) и +2 (Be, Mg и щелочноземельные металлы). К их важнейшим соединениям относятся: · оксиды: Me2O и MeO, · гидроксиды: MeOH и Me(OH)2, · гидриды: MeH и MeH2, · cоли. Оксиды и гидроксиды s-металлов имеют основной характер, усиливающий с ростом металличности элементов. Например, NaOH Mg(OH)2
LiOH, NaOH, KOH, CsOH, FrOH
Исключением являются BeO и Be(OH)2, обладающие амфотерными свойствами. Амфотерность ― это кислотно-основная двойственность. Так, Be(OH)2 диссоциирует как по кислотному, так и по основному типу: 2 H+ + BeO22- Гидриды s-металлов ― это твердые солеподобные вещества ионного типа, легко разлагающиеся водой и кислотами: MgH2 + 2 H2O → Mg (OH)2 + 2 H2 MgH2 + 2 HCl → MgCl2 + 2 H2 Особое положение среди s-элементов занимает водород. Согласно современным представлениям, водород с электронной конфигурацией 1s1 нельзя отнести к какой-либо группе; его следует считать просто первым элементом периодической системы. К важнейшим биогенным элементам s-блока, кроме H, относятся Na, K, Ca и Mg. Все они являются макроэлементами. К высокотоксичным элементам относится барий. Например, высшей летальной дозой BaCl2 является 1 г на 70 кг массы тела человека.
Химия d-элементов
Элементами d-блока (или переходными элементами) называются элементы, атомы которых имеют электронную конфигурацию ns2(n-1)dх, где х = 1 - 10. Исключение составляют Ag, Cu, Au, Cr, Pt, Nb, Ru, Rh и некоторые другие элементы, для которых формула валентного слоя ns1(n-1)dх, где х = 5 или 10. Такое изменение электронной конфигурации атомов связано с электронным проскоком. Появление электронного проскока объясняется повышенной стабильностью d-подуровня: (а) полностью заполненного электронами (d10), (б) заполненного на половину (d5). Элементы d-блока расположены в побочных подгруппах I Б –VIII Б; они являются металлами средней и низкой активности, уступая по металличности элементам s- и p-блоков. Особенностью d-элементов является отсутствие монотонности в изменении их свойств как в подгруппах сверху вниз, так и в периодах слева направо. Причиной этого явления является эффект d-сжатия (рисунок 59), вызванный проникновением внешних d-электронов к ядру и приводящий к уменьшению атомного радиуса. Сильнее всего эффект d-сжатия проявляется у d1-, d2- и d3-элементов, он практически отсутствует у d9- и d10-элементов.
Рисунок 59 ― Зависимость атомных
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1683; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.99.221 (0.011 с.) |


 Fe2+ + 6 CN‾
Fe2+ + 6 CN‾


 Уменьшение основности
Уменьшение основности Увеличение основности
Увеличение основности




