Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика ферментативных реакций.Содержание книги
Поиск на нашем сайте
Практически все биохимические реакции являются ферментативными. Ферменты (биокатализаторы) — это вещества белковой природы, активированные катионами металлов. Известно около 2000 различных ферментов, а примерно 150 из них выделены, причем некоторые используются в качестве лекарственных препаратов. Трипсин и химотрипсин применяются для лечения бронхитов и пневмонии; пепсин — для лечения гастрита; плазмин — для лечение инфаркта; панкреатин – для лечение поджелудочной железы. Ферменты отличаются от обычных катализаторов: (а) более высокой каталитической активностью; (б) высокой специфичностью, т.е. избирательностью действия. Механизм односубстратной ферментативной реакции можно представить схемой:
где Е — фермент, S — субстрат, ЕS — фермент-субстратный комплекс, Р — продукт реакции. Характеристикой первой стадии ферментативной реакции является константа Михаэлиса (КМ). КМ является величиной, обратной константе равновесия:
константа Михаэлиса (КМ) характеризует устойчивость фермент-субстратного комплекса (ES). Чем меньше константа Михаэлиса (КМ), тем устойчивее комплекс. Скорость ферментативной реакции равна скорости ее лимитирующей стадии:
где k2 – константа скорости, называемая числом оборотов или молекулярной активностью фермента. молекулярная активность фермента (k2) равна числу молекул субстрата, претерпевающих превращения под воздействием одной молекулы фермента за 1 минуту при 250С. Данная константа принимает значения в диапазоне: 1·104 < k2 < 6·106 мин‾1. Для уреазы, ускоряющей гидролиз мочевины, k2 = 1,85∙106 мин‾1; для аденозинтрифосфатазы, ускоряющей гидролиз АТФ, k2 = 6,24∙106 мин‾1; для каталазы, ускоряющей разложение Н2О2, k2 = 5∙106 мин‾1. Однако кинетическое уравнение ферментативной реакции в той форме, в которой оно приведено выше, практически невозможно использовать из-за невозможности экспериментального определения концентрации фермент-субстратного комплекса ([ES]). Выразив [ES] через другие величины, легко определяемые экспериментальным путем, получаем кинетическое уравнение ферментативных реакций, называемое уравнением Михаэлиса-Ментен (1913):
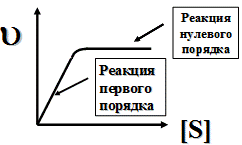
где произведение k2[E]общ является величиной постоянной, которую обозначают Соответственно: Рассмотрим частные случаи уравнения Михаэлиса-Ментен. 1) При низкой концентрации субстрата KM >> [S], поэтому
что соответствует кинетическому уравнению реакции первого порядка. 2) При высокой концентрации субстрата Км << [S], поэтому
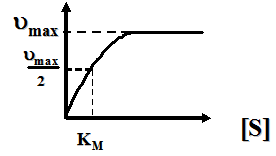
что соответствует кинетическому уравнению реакции нулевого порядка. Таким образом, при низкой концентрации субстрата скорость ферментативной реакции возрастает с увеличением содержания субстрата в системе, а при его высокой концентрации – кинетическая кривая выходит на плато (скорость реакции не зависит от концентрации субстрата) (рис. 30).
Рисунок 30. — Кинетическая кривая ферментативной реакции
Если [S] = КМ, то
что позволяет графически определять константу Михаэлиса Км(рис. 31).
Рисунок 31. — Графическое определение константы Михаэлиса
На активность ферментов оказывают влияние: (а) температура, (б) кислотность среды, (в) наличие ингибиторов. Влияние температуры на скорость ферментативной реакции рассмотрено в главе 9.3. Влияние кислотности среды на скорость ферментативной реакции представлено на рисунке 32. Максимальная активность фермента соответствует оптимальному значению водородного показателя (рНопт).
Рисунок 32. — Влияние кислотности растворов на активность ферментов
Для большинства ферментов оптимальные значения рН совпадают с физиологическими значениями (7,3 - 7,4). Однако существуют ферменты, для нормального функционирования которых нужна сильнокислая (пепсин — 1,5- 2,5) или достаточно щелочная среда (аргиназа — 9,5 - 9,9). Ингибиторы ферментов — это вещества, занимающие часть активных центров молекул фермента, в результате чего скорость ферментативной реакции уменьшается. В роли ингибиторов выступают катионы тяжелых металлов, органические кислоты и другие соединения.
Лекция 11 Строение атома
Существуют два определения понятия «атом». Атом — это мельчайшая частица химического элемента, сохраняющая его химические свойства. Атом — это электронейтральная микросистема, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Учение об атоме прошло длительный путь развития. К основным этапам развития атомистики относят: 1) натурфилософский этап — период формирования концепции об атомном строении материи, не подтвержденной экспериментом (V век до н.э. - 16 век н.э.); 2) этап формирования гипотезы об атоме как мельчайшей частице химического элемента (XVIII-XIX в.в.); 3) этап создания физических моделей, отражающих сложность строения атома и позволяющих описать его свойства (начало XX в.) 4) современный этап атомистики называется квантово-механическим. Квантовая механика – это раздел физики, изучающий движение элементарных частиц.
ПЛАН 11.1. Строение ядра. Изотопы. 11.2. Квантово-механическая модель электронной оболочки атома. 11.3. Физико-химические характеристики атомов.
Строение ядра. Изотопы
Ядро атома — это положительно заряженная частица, состоящая из протонов, нейтронов и некоторых других элементарных частиц. Принято считать, что основными элементарными частицами ядра являются протоны и нейтроны. Протон (p) – это элементарная частица, относительная атомная масса которой равна 1 а.е.м, а относительный заряд составляет + 1. Нейтрон (n) – это элементарная частица, не имеющая электрического заряда, масса которой равна массе протона. В ядре сосредоточено 99,95 % массы атома. Между элементарными частицами действуют особые ядерные силы протяжения, значительно превосходящие силы электростатического отталкивания. Фундаментальной характеристикой атома является заряд его ядра, равный числу протонов и совпадающий с порядковым номером элемента в периодической системе химических элементов. Совокупность (вид) атомов с одинаковым зарядом ядра называется химическим элементом. В природе найдены элементы с номерами от 1 до 92. Изотопы — это атомы одного химического элемента, содержащие одинаковое количество протонов и разное количество нейтронов в ядре.
где массовое число (А) – это масса ядра, z – заряд ядра. Каждый химический элемент представляет собой смесь изотопов. Как правило, название изотопов совпадает с названием химического элемента. Однако для изотопов водорода введены особые названия. Химический элемент водород представлен тремя изотопами:
Число р Число n Протий Н 1 0 Дейтерий Д 1 1 Тритий Т 1 2 Изотопы химического элемента могут быть как стабильными, так и радиоактивными. Радиоактивные изотопы содержат ядра, самопроизвольно разрушающиеся с выделением частиц и энергии. Стабильность ядра определяется его нейтронно-протонным отношением.
Попадая в организм, радионуклиды нарушают протекание важнейших биохимических процессов, снижают иммунитет, обрекают организм на болезни. Организм защищает себя от воздействия радиации, избирательно поглощая элементы из окружающей среды. Стабильные изотопы имеют приоритет перед радиоактивными изотопами. Другими словами, стабильные изотопы блокируют накопление радиоактивных изотопов в живых организмах (таб. 8). В книге С.Шеннон «Питание в атомном веке» приводятся следующие данные. Если блокирующую дозу стабильного изотопа йода, равную ~100 мг, принять не позднее чем через 2 часа после попадания I-131в организм, то поглощение радиойода в щитовидной железе снизится на 90%. Радиоизотопы применяются в медицине · для диагностики некоторых заболеваний, · для лечения всех форм онкологических заболеваний, · для патофизиологических исследований.
Таблица 8 — Блокирующее действие стабильных изотопов
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 882; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.127.59 (0.008 с.) |



 = k2 [ES],
= k2 [ES], ,
,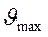 (максимальная скорость).
(максимальная скорость).

 ,
,
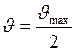 ,
,