
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация лигандов по дентантностиСодержание книги
Поиск на нашем сайте
(1) монодентантные лиганды: а) анионы: OH‾, H‾, F‾, Cl‾, Br‾, I‾, CN‾, CNS‾, NO2‾, NO3‾; б) молекулы: NH3, H2O, CO; в) катионы: NH2NH3+. (2) бидентантные лиганды: а) анионы: SO42‾, C2O42‾, CO32‾; б) молекулы: NH2 – CH2 – CH2 – NH2 (этилендиамин) NH2 – CH2 – COOH (глицин) (3) полидентантные лиганды. Важнейшими из них являются комплексоны – аминополикарбоновые кислоты и их соли. К широко используемым комплексонам относится этилендиаминтетрауксусная кислота (ЭДТА),
а также ее динатриевая соль(Na2H2Y),известная как Трилон Б:
Комплексоны находят применение в медицине для лечения мочекаменной болезни. Они способны растворять камни, образующиеся в почках и мочевом пузыре. Процесс растворения оксалатного камня описывается уравнением: CaC2O4 + Na2H2Y Комплексоны широко используются в аналитической химии. Например, метод комплексонометрии является одним из методов объемного анализа, в основе которого лежит реакция комплексообразования: Me2+ + Na2H2Y Метод комплексонометрии позволяет определять содержание катионов металлов Ca2+, Mg2+, Fe2+, Fe3+ и др. в растворах и биологических жидкостях.
Классификация комплексных соединений 1) по природе лигандов а) Комплексы с монодентантными лигандами: • аммиакаты [Cu(NH3)4]Cl2 • аквакомплексы [Cu(H2O)4]SO4 • гидроксокомплексы Na[Al(OH)4] • ацидокомплексы Na[Ag(CN)2] • со смешанными лигандами [Pt(NH3)2Cl2] б) Комплексы с би- и полидентантными лигадами. Особую группу составляют хелатные (клешневидные) комплексы, содержащие полидентантные лиганды, образующие замкнутые циклы. Например, комплекс меди с этилендиамином:
Наиболее устойчивыми являются внутрикомплексные соединения, в которых часть связей металл - лиганд образованы по обменному, а часть ― по донорно-акцепторному механизму. Примером такого соединения является комплекс кальция с Трилоном Б, известный в медицине как тетацин:
Тетацин применяется в медицине как лекарственный препарат для детоксификации организма при отравлении тяжелыми металлами. Приведенное ниже уравнение описывает связывание токсичных катионов ртути в прочный комплекс, легко выводящийся из организма с мочой: Hg2+ + [CaY]2‾ ® Ca2+ + [HgY]2‾. 2) По скорости образования комплексов: (а) лабильные, образующиеся с высокой скоростью; (б) инертные, образующиеся с низкой скоростью.
Номенклатура комплексных соединений 1) Вначале называют катионы, а затем анионы. Названия комплексных анионов заканчиваются суффиксом – ат. 2) В комплексном ионе сначала называют лиганды-анионы, затем лиганды-молекулы, затем лиганды-катионы: Лиганды - молекулы имеют специфические названия. Например, NH3 – аммин, H2O – аква, СО – карбонил. Названия лигандов-анионов заканчиваются на – о: OH‾ ― гидроксо NO2‾ ― нитро NO3‾ ― нитрато CN‾ ― циано СNS‾ ― родано SO42‾ ― сульфато Катион-лиганд NH2NH3+ имеет название гидразиниум. Названия некоторых комплексообразователей зависит от того, в состав катиона или аниона они входят (таблица 13).
Таблица 13 ― Название некоторых комплексообразователей
3) Степень окисления комплексообразователя указывают, если у металла их несколько. Ниже приведены названия некоторых комплексных соединений: Na[Al(OH)4] ―- натрий тетрагидроксоалюминат [Cu(NH3)4]SO4 ― тетраамминмедь(II) сульфат NH4[Co(NH3)2(NO2)4] ― аммоний тетранитродиамминкобальтат(III) [Pt(NH3)2Cl2] ― дихлородиамминплатина
Строение КС
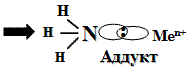
Строение комплексных соединений описывается либо в рамках метода валентных связей (метод ВС), либо с позиции теории кристаллического поля.С позиций метода ВС связи металл — лиганд являются ковалентными полярными, образованными по донорно-акцепторному механизму. Лиганды выступают в роли доноров электронных пар, а комплексообразователи — в роли их акцепторов. Схема взаимодействия металлов и лигандов представлена на рисунок 54.
Рисунок 54 — Схема взаимодействия металлов и лигандов
Конфигурация комплексного иона определяется типом гибридизации атомных орбиталей комплексообразователя (таблица 14).
Таблица 14 — Конфигурация комплексных ионов.
Теория кристаллического поля исходит из того, что металлы и лиганды связаны между собой силами электростатического притяжения. Эта теория рассматривает воздействие лигандов на d-орбитали иона-комплексообразова-теля. Если катион металла находится в симметричном магнитном поле, его d-орбитали имеют одинаковый запас энергии (являются вырожденными). Если ион находится в октаэдрическом, тетраэдрическом или другом несимметричном поле лигандов, то происходит расщепление его d-подуровня (рисунки 55-56).
Рисунок 55 — Расщепление d-подуровня в октаэдрическом поле
Рисунок 56 — Расщепление d-подуровня в тетраэдрическом поле
Величина энергии расщепления (∆) зависит от конфигурации комплекса и природы лиганда.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 8049; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.71.13 (0.008 с.) |



 [CaY]2‾ + Na2C2O4 + 2 H+.
[CaY]2‾ + Na2C2O4 + 2 H+.


 линейная
линейная
 Квадратно-плоскостная
Квадратно-плоскостная







