Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотность водных растворов и биологических жидкостейСодержание книги
Поиск на нашем сайте
Кислотность является важной характеристикой, как водных растворов, так и биологических жидкостей. Она определяется соотношением концентраций ионов Н+ и ОН-. Для характеристики кислотности используется водородный показатель (рН): рН = - lg[H+] для слабых электролитов, рН = - lg аН+ для сильных электролитов, где [H+] — молярная концентрация катионов водорода, моль/л аН+ — активность катионов водорода. Реже для характеристики реакции среды используется гидроксильный показатель (рОН): рОН = - lg[OH-] для слабых электролитов рОН = - lg аOH- для сильных электролитов, где [ОН-] — молярная концентрация гидроксид-ионов, аОН‾‾ — активность гидроксид-ионов, моль/л. Для одного раствора рН + рОН = 14 Используя уравнение: КW = [H+] [OH-] = 10-14, рассчитаем концентрации ионов внейтральном растворе: [H+] = [OH-] = Соответственно рН = - lg 10-7 = 7 рOН = -lg 10-7 = 7 В кислой среде: [H+] > [OH-] рН < 7, рОН > 7 В щелочной среде: [H+] < [OH-] pH > 7, pOH < 7
Рисунок 13. — Шкала рН
Водородный показатель является важной характеристикой биологических жидкостей человека. Таблица 5 — Кислотность биологических жидкостей человека
Для биологических жидкостей характерен кислотно-основной гомеостаз (постоянство значений рН), обусловленный действием биологических буферных систем. Нарушение гомеостаза чрезвычайно опасно для здоровья человека. Наиболее опасными видами нарушения кислотно-основного равновесия в организме являются: · ацидоз — увеличение кислотности крови, · алкалоз — увеличение щелочности крови. Опасность изменения кислотности связана: (1) со снижением активности ферментов и гормонов, активных лишь в узком диапазоне рН; (2) с изменением осмотического давления биологических жидкостей; (3) с изменением скорости биохимических реакций, катализируемых катионами Н+. Изменение рН крови на 0,3 единицы вызывает тяжелое коматозное состояние, а при изменении кислотности на 0,4 единицы возможен летальный исход. Для коррекции ацидоза используют внутривенное введение 4%-ного раствора натрий гидрокарбоната NaHCO3: HCO3- + H+ NaHCO3 является антацидным (гипоцидным) препаратом. Антацидными называются лекарственные препараты, снижающие кислотность биологических жидкостей. Одним из способов коррекции алкалоза является внутривенное введение растворов аскорбиновой кислоты (5% или 15%). К основным методам определения кислотности растворов следует отнести: 1. Кислотно-основное титрование. 2. Кислотно-основные индикаторы. 3. Потенциометрический метод.
Буферные растворы
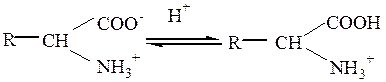
Буферными называют растворы, рН которых не изменяется при добавлении небольших количеств кислот или щелочей, а также при разбавлении их водой. Механизм буферного действия можно объяснить при помощи основных положений протолитической теория кислот и оснований Бренстеда-Лоури (1923). Согласно этой теории, кислота — это донор протонов, а основание – их акцептор. С точки зрения протолитической теории различают: · кислоты–молекулы (CH3COOH), · кислоты-катионы (NH4+), · кислоты–анионы (H2PO4-). Кислота отдает протон и превращается в сопряженное с ней основание. Ниже приведены примеры нескольких сопряженных пар: СH3COOH Кислота Сопряженное основание
NH4+ Кислота Сопряженное основание
H2PO4- Кислота Сопряженное основание Буферный раствор содержит как кислоту, так и сопряженное с ней основание. Именно поэтому он способен нейтрализовывать как добавленную кислоту, так и добавленное основание. Классификация буферных растворов 1) Слабая кислота/ ее соль Например, ацетатный буфер: СН3СООН/СН3СООNa Механизм буферного действия: Нейтрализация добавленной кислоты: НCl + CH3COONa Нейтрализация добавленной щелочи NaOH+ CH3COOH 2) Слабое основание/его соль Например, аммиачный буфер: NН3/NН4Сl Механизм буферного действия: Нейтрализация добавленной кислоты: НCl + NH3 Нейтрализация добавленной щелочи NaOH+ NH4Cl 3) Две кислые соли Например, гидрофосфатный буфер: NаН2PO4/Nа2НPO4 Механизм буферного действия: Нейтрализация добавленной кислоты: НCl + Na2HPO4 Нейтрализация добавленной щелочи NaOH+ NаH2PO4 → Na2HPO4 + H2O 4) кислая соль/средняя соль Например, гидрокарбонатный буфер: NаНСO3/Nа2СO3 Механизм буферного действия: Нейтрализация добавленной кислоты: НCl + Na2СO3 Нейтрализация добавленной щелочи NaOH+ NаHСO3
Уравнение Гендерсона-Гассельбаха позволяет рассчитать рН буферного раствора: рН = рКа – где рКа = – lg Ka Важной хапактеристикой растворов является их буферная емкость. Буферная емкость раствора (В, ммоль/л) — это количества сильных кислот или щелочей, при прибавлении которых к 1 л буферного раствора, происходит изменение рН на единицу:
где Сн — нормальность добавляемых кислот или щелочей, моль/л V — их объем, мл Vбр — объем буферного раствора, л. Буферная емкость зависит: (1) от концентрации раствора: чем концентрированнее раствор, тем больше его буферная емкость; (2) от соотношения концентраций компонентов:
Чем больше буферная емкость раствора, тем эффективнее он поддерживает кислотно-основное равновесие. Характеристиками биологических буферных систем являются буферная емкость по кислоте (Bк) и буферная емкость по щелочи (Bщ). Как правило, Bк > Bщ. Это объясняется тем, что в организме человека количество кислотных метаболитов значительно превышает количество метаболитов щелочных. Например, в теле человека в спокойном состоянии ежесуточно образуется такое количество кислоты, которое эквивалентно 2,5 л концентрированной соляной кислоты HCl.
Буферные системы крови Из буферных систем организма наибольшей емкостью характеризуются буферные системы крови. Они распределены между эритроцитами и плазмой (рисунок 14).
Рисунок 14. — Буферные системы крови Гидрокарбонатный (водокарбонатный) буфер: H2CO3/HCO3- Его образование описывается схемой: СО2 + Н2О Механизм буферного действия можно представить следующим образом: Н+ + НСО3 ОН- + Н2СО3 В крови отношение концентрация угольной кислоты и гдрокарбонат-иона составляет:
Избыток гидрокарбоната создает щелочной резерв крови. Для данного буфера Вк = 40 ммоль/л, а Вщ = 1-2 ммоль/л. Гидрокарбонатный буфер связан со всеми буферными системами вне- и внутриклеточных жидкостей. Всякие изменения в них сказываются на концентрации составляющих данного буфера. Анализируя содержание НСО3- в крови можно диагностировать наличие дыхательных и метаболических нарушений. Гидрофосфатная буферная система: Н2PO4-/HPO42- Механизм ее буферного действия рассмотрен в разделе 7.2. Для этого буфера Вк = 1-2 ммоль/л, а Вщ = 0,5 ммоль/л. Его низкая буферная емкость объясняется низкой концентрацией ионов в крови. Однако эта система играет решающую роль в других биологических жидкостях: в моче, соках пищеварительных желез, а также во внутриклеточных жидкостях. Гемоглобин-оксигемоглобин: ННb/Нb- Гемоглобин ННb — это слабая кислота (Ка = 6,37·10-9), обратимо диссоциирующая в водном растворе: ННb Механизм буферного действия гемоглобина описывается следующими уравнениями: Н+ + Нb- ОН- + ННb В эритроцитах гемоглобин окисляется до оксигемоглобина: HHb + O2 Оксигемоглобин так же является слабой кислотой (Ка = 1,17·10-7), поэтому в состав оксигемоглобинового буфера входят HHbO2 и анион HbO2- . Механизм буферного действия оксигемоглобина описывается следующими уравнениями: H+ + HbO2- OH- + HHbO2 Буферная система гемоглобин-оксигемоглобин обеспечивает 75% буферной емкости крови. Белковая буферная система (альбумины, глобулины). Белки являются амфотерными полиэлектролитами, существующими в виде биполярных ионов:
Механизм буферного действия: (а) нейтрализация кислот:
(б) нейтрализация оснований:
Вк (альбуминов) = 10 ммоль/л, а Вк (глобулинов) = 3 ммоль/л. Белковые буферы содержатся не только в крови, но практически во всех биологических жидкостях.
Лекция 8 Электрохимия План 8.1. Термодинамика окислительно-восстановительных реакций. 8.2. Устройство и принцип действия гальванических элементов. 8.3. Потенциометрические методы анализа.
Электрохимия — это раздел химической науки, изучающий электрохимические процессы. Электрохимическими называются процессы: а) протекающие в растворе под воздействием электрического тока (электролиз); б) протекающие в растворе и приводящие к возникновению электрического тока во внешней цепи (гальванический элемент). Большинство электрохимических процессов являются окислительно-восстановительными (ОВР).
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1736; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.176.176 (0.011 с.) |

 = 10-7моль/л
= 10-7моль/л
 H2CO3
H2CO3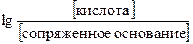 ,
,