Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация дисперсных системСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
По степени дисперсности коллоидные системы делятся на: (а) коллоидно-дисперсные (10‾9< α< 10‾7м); (б) грубо-дисперсные (10‾7< α < 10‾5м). где a- диаметр частицы дисперсной фазы. По степени взаимодействия дисперсной фазы и дисперсионной среды (под их взаимодействием понимают образование сольватных оболочек вокруг частиц дисперсной фазы) различают: (а) лиофильные системы. Лиофильнымиявляются системы, в которых сильно выражен эффект сольватации (растворы ВМС и ПАВ). Они устойчивы; их образование протекает самопроизвольно. (б) лиофобные дисперсные системы.Лиофобными являются системы, в которых эффект сольватации отсутствуют (например, дисперсии металлов и труднорастворимых солей). Они не устойчивы; их образование протекает несамопроизвольно. По отсутствию или наличию межмолекулярного взаимодействия между частицами дисперсной фазы системы подразделяются на: (а) свободнодисперсионные дисперсные системы. Свободнодисперсионные системы — это системы, в которых частицы не связаны между собой и свободно перемещаются (например, аэрозоли и лиозоли). (б) связнодисперсные дисперсные системы. Связнодисперсные системы — это системы, в которых частицы связаны между собой силами межмолекулярного взаимодействия. Как следствие, движение частиц движение затруднено (гели, студни). Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды приведена в таблице 26.
Таблица 26 — Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
Согласно современным представлениям, любое твердое тело — это высокодисперсная система, так как размеры дефектов кристаллических решеток соответствуют размерам коллоидных частиц.
16.2. Получение и очистка коллоидных растворов
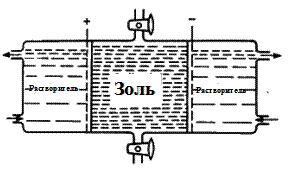
Для получения коллоидных растворов (золей) используют: а) метод диспергирования, б) метод конденсации. Метод диспергирования — это дробление крупных частиц до коллоидной степени дисперсности. Диспергирование можно осуществлять: (а) механическим дроблением (шаровые, коллоидные мельницы); (б) электрическим распылением в вольтовой дуге (получение золей золота, серебра, платины и других металлов); (в) действием ультразвука. Особым способом диспергирования является метод пептизации, то есть дробление свежеприготовленных осадков на отдельные коллоидные частицы при добавлении небольшого количества электролита-пептизатора в раствор. Различают адсорбционную и химическую пептизацию. При адсорбционной пептизации ионы электролита-пептизатора адсорбируются на поверхности частиц осадка, сообщая им одноименный электрический заряд и способствуя переходу во взвешенное состояние. При химической пептизации электролит-пептизатор образуется в результате химической реакции, протекающей в растворе. Пептизация имеет большое биологическое значение. Например, рассасывание атеросклеротических бляшек, почечных и печеночных камней происходит под воздействием лекарственных препаратов, являющихся пептизаторами. Метод конденсации — это соединение атомов, молекул или ионов в агрегаты коллоидной степени дисперсности. Конденсационные методы получения дисперсных систем делятся на химические и физические. В основе химической конденсации лежат химические реакции, проте- кающие с образованием труднорастворимых соединений. Например, получение дисперсии радиоактивного золота, применяемого для лечения онкологических заболеваний, осуществляется в результате окислительно-восстановительной реакции: H[AuCl4] + 3 H2O2 → 2 Au↓+ 8 HCl + 3 O2 Получение протаргола (сильнодействующего антисептика) возможно в результате реакции ионного обмена: AgNO3 + KI → AgI↓ + KNO3 Кроме того, многие золи образуются как продукты гидролиза солей: FeCl3 + 3 H2O Получение дисперсных систем методом физической конденсации выполняют: (а) путем замены растворителя, (б) понижением температуры или повышением давления паров и газов. Сущность метода замены растворителя заключается в том, что в истинный раствор добавляют жидкость, в которой растворенное вещество практически не растворимо. При понижении температуры или повышении давления паров и газов происходит их конденсация. Так в природе образуются туманы и облака. В организме превалирующим является конденсационный метод. Одним из немногих примеров диспергирования является эмульгирование жиров в кишечнике. К методам очистки золей относятся: (а) диализ и электродиализ, (б) ультрафильтрация. При помощи диализа и электродиализа происходит очистка золей от электролитов. Диализ основан на применении мембран, задерживающих крупные коллоидные частицы и пропускающих ионы и молекулы низкомолекулярных веществ (рисунок 62).
Рисунок 62 — Простейший диализатор
Диализ протекает медленно, но он может быть ускорен путем пропускания электрического тока через золь, подлежащий очистке. Такой процесс получил название электродиализа, а соответствующий прибор — электродиализатора (рисунок 63).
Рисунок 63 — Простейший электродиализатор
Ультрафильтрация — это отделение дисперсной фазы от дисперсионной среды, осуществляемое путем продавливания золя через плотные фильтры, непроницаемые для частиц дисперсной фазы. Фильтрование обычно проводят под давлением или в вакууме. Применяя мембраны с определенной степенью пористости, можно не только разделять коллоидные частицы, но и определять их размеры. Этим методом впервые были определены размеры целого ряда вирусов и бактериофагов. Процесс ультрафильтрации лежит в основе работы почек. Вещества с молярной массой до 10000 свободно проходят через сито базальной мембраны, а с молярной массой свыше 50 000 — проходят только в ничтожных количествах. Примером сочетания диализа и ультрафильтрации является аппарат "искусственная почка", предназначенный для временной замены почек при почечной недостаточности. Аппарат подключают к системе кровообращения больного. Кровь под давлением, создаваемым пульсирующим насосом ("искусственное сердце"), протекает в зазоре между двумя мембранами, омываемыми снаружи физиологическим раствором (рисунок 64). Благодаря большой площади мембран (~15000 см2) из крови сравнительно быстро (3-4 ч) удаляются "шлаки" — продукты обмена и распада тканей (мочевина, креатинин, ионы калия и др.). Данный метод лечения называется гемодиализом.
Рисунок 64 — Прибор «Искусственная почка»
16.3. Строение мицелл лиофобных золей
Согласно мицеллярной теории, золь состоит из мицелл и интермицеллярной жидкости. Мицелла —это электронейтральная частица дисперсной фазы, окруженная двойным электрическим слоем ионов. Интермицеллярная жидкость — это дисперсионная среда, разделяющая мицеллы Основу мицеллы составляют микрокристаллы трудно-растворимого вещества, называемые агрегатом. В результате избирательной адсорбции на поверхности агрегата адсорбируются ионы электролита-стабилизатора. Пример. Рассмотрим строение мицеллы золя AgI, образующегося в результате реакции (рисунок 65): AgNO3 + KI → AgI + KNO3 Если в избытке находится AgNO3, то именно он является стабилизатором т.к. сообщает устойчивость коллоидным частицам. Из его ионов формируется двойной электрический слой вокруг агрегата: AgNO3 → Ag+ + NO3-
Рисунок 65 — Формула мицеллы AgI, стабилизированной ионами электролита AgNO3
ПОИ — потенциалопредляющие ионы, адсорбирующиеся на поверхности агрегата, ПРИ — противоионы, адсорбирующиеся на поверхности ядра; они входят как в состав адсорбционного, так и в состав диффузного слоя. Коллоидная частица (гранула) — это часть мицеллы, состоящая из агрегата и адсорбционного слоя. Заряд гранулы рассчитывают как алгебраическую сумму ионов, входящих в ее состав: +n - 1(n-х) = +n – n + х = + x Пример. Рассмотрим строение мицеллы золя AgI, образующегося в результате реакции (рисунок 66): AgNO3 + KI → AgI + KNO3, протекающей при избытке KI. В данном случае электролитом-стабилизатором является КI, диссоциирующий на ионы по уравнению: KI → K+ + I- Из ионов К+ и I- формируется двойной электрический слой вокруг агрегата.
Рисунок 66 — Формула мицеллы AgI, стабилизированной ионами Электролита КI
Заряд коллоидной частицы равен: - n + 1(n-x) = - n + n – x = - x. Образование двойного электрического слоя (ДЭС) приводит к тому, что на поверхности раздела адсорбционного и диффузного слоя появляется электрический потенциал, называемый электрокинетическим (дзета) потенциалом (ξ). ξ–потенциал служит мерой устойчивости коллоидных частиц, а так же мерой размеров межклеточных пространств in vivo.
Физические свойства золей
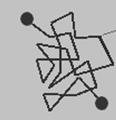
Физические свойства коллоидных растворов можно разделить на три основных категории: а) молекулярно-кинетические свойства, б) электрокинетические свойства; в) оптические свойства. К важнейшим молекулярно-кинетическим свойствам относятся броуновское движение, диффузия и седиментация. Броуновское движение — это хаотическое движение частиц дисперсной фазы под воздействием ударов молекул дисперсионной среды (рисунок 67). Диффузия — это самопроизвольный процесс выравнивания концентраций частиц по всему объему раствора в результате броуновского движения. Характеристикой диффузии является ее коэффициент D, зависящий от размеров частиц (r) и вязкости среды (h):
где D – коэффициент диффузии, м2/с; r — размер частиц дисперсной системы, м; h — вязкость дисперсионной среды, Н·с/м2; NA — постоянная Авогадро, равная 6,02·1023 моль-1; R — универсальная газовая постоянная, равная 8,314 Дж/моль·К; T — температура, К π = 3,141592654
Рисунок 67 — Траектория броуновского движения коллоидной частицы
Седиментация — это оседание частиц дисперсной фазы под действием силы тяжести. Седиментации противостоит броуновское движение, что приводит к установлению седиментационного равновесия. Седиментационное равновесие характеризуется постепенным увеличением концентрации дисперсной фазы от верхних слоев к нижним (рисунок 68).
Рисунок 68 — Распределение частиц дисперсной фазы в золе
Определение скорости оседания положено в основу седиментационного анализа. Он широко используется для качественной оценки состояния эритроцитов. Определение скорости оседания эритроцитов СОЭ — важный диагностический тест. Электрокинетическими явлениями называются процессы, протекающие в золях под воздействием внешнего электрического поля. К важнейшим электрокинетическим явлениям относятся электрофорез и электроосмос. Электрофорез (электро... и греч. phoresis - несение) — это направленное движение коллоидных частиц под действием внешнего электрического поля относительно неподвижной дисперсионной среды. Электрофорез был открыт Ф. Рейсом в 1807. Скорость движения частиц к электродам (u) связана с напряжённостью электрического поля (Е) уравнением Смолуховского:
где u — скорость движения частиц дисперсной фазы,м/с; h — вязкость среды, Н·с/м2; ε – относительная диэлектрическая проницаемость среды; Е — напряжённостью электрического поля, (градиент потенциала); ξ — электрокинетический потенциал, В; π = 3,141592654. Электрофорез широко применяется в медицине и биологии, т.к. коллоидные частицы белков, бактерии и вирусы несут заряд и способны двигаться в электрическом поле к катоду или аноду с определенной скоростью. Метод применяется в медицине для диагностики и контроля за ходом болезни. Так, в электрофореграммах белков сыворотки крови при различных патологических состояниях наблюдается резкие изменения, специфичные для каждого заболевания. Электрофорез клеточных частиц представляет особый интерес для гематологии и иммунологии. Все клетки позвоночных животных имеют отрицательный заряд. Каждый тип клеток характеризуется вполне определенным значением электрокинетического потенциала. В 50-х годах 20 века было обнаружено различие ξ– потенциала опухолевых клеток в зависимости от штамма и возраста клетки. Электрофорез клеток нашел применение для оценки клеточного иммунитета у онкологических больных. Введение лекарственных веществ методом электрофореза имеет ряд преимуществ по сравнению с обычными способами их использования: · лекарственное вещество поступает в виде ионов, что повышает его фармакологическую активность; · образование «кожного депо» увеличивает продолжительность действия лекарственного средства; · высокая концентрация лекарственного вещества создается непосредственно в патологическом очаге; · не раздражается слизистая оболочка желудочно-кишечного тракта; · обеспечивается возможность одновременного введения нескольких (с разных полюсов) лекарственных веществ. Лекарственный электрофорез находит широкое применение при лечении заболеваний сердечнососудистой системы, в онкологической практике, при лечении туберкулеза. Электроосмос — это движение дисперсионной среды относительно неподвижной дисперсной фазы через полупроницаемую мембрану во внешнем электрическом поле. В медицине электроосмос применяется для очистки лечебных сывороток. Особые оптические свойства дисперсных систем обусловлены тем, что размеры коллоидных частиц сопоставимы с длиной волны видимого света. Это приводит к рассеянию света, проходящего через золь (рисунок 69).
Рисунок 69. — Рассеяние света, проходящего через золь.
Если луч света направить на коллоидный раствор сбоку, то его путь будет обнаруживаться на темном фоне в виде светящегося конуса, называемого конусом Тиндаля (рисунок 70).
Рисунок 70 — Конус Тиндаля
Основанные на эффекте Тиндаля методы определения размера и концентрации коллоидных частиц (ультрамикроскопия и нефелометрия) широко применяются в научных исследованиях и промышленной практике. Короткие волны (синяя и фиолетовая часть спектра) рассеиваются сильнее, чем длинные (желто-красная часть спектра). Этим объясняется голубой цвет неба.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1658; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.132.80 (0.009 с.) |

 Fe(OH)3↓ + 3 HCl.
Fe(OH)3↓ + 3 HCl.