
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 8. Стійкість та коагуляція дисперсних систем.
Конкретні цілі: 1. Стійкість колоїдних розчинів та її види. 2. Коагуляція і фактори, що її викликають. Коагуляція: повільна та швидка. Поріг коагуляції та його визначення. Правило ІІІульце- Гарді. 3. Теорія коагуляції ДЛФО. Нейтралізаційна та концентраційна коагуляції. 4. Коагуляція золів сумішшю електролітів. Взаємна коагуляція. Явище звикання. Колоїдний захист. Значення стабілізації колоїдних систем для приготування ліків.
Джерела інформації: 1. Физическая и коллоидная химия / Под ред. В.И.Кабачного, - Харьков: Изд-во НФаУ, 2005, с. 276-283. 2. Физическая и коллоидная химия: Учебн. Для фарм. Вузов и факультетов / Под ред. К.И.Евстратовой.- М.: Высш. шк., 1990, с. 424-440.
Тестові завдання до теми 8 «Стійкість та коагуляція дисперсних систем»: 1. У клінічних аналізах визначається швидкість осідання еритроцитів(ШОЕ). За наявності патології еритроцити адсорбують великі молекули γ-глобулінів і фібриногенів. В результаті цього частки стають більшими і важчими, а ШОЕ збільшується. Це обумовлено:
A. коацервацією дисперсних часток B. конденсацією дисперсних часток C. пептизацією дисперсних часток D. коагуляцією дисперсних часток E. концентрацією дисперсних часток
2. Кров - типова колоїдна система. В результаті складного ферментативного процесу відбувається її згортання, що забезпечує мінімальну втрату крові. Це обумовлено здатністю колоїдних часток до:
A. адгезії B. адсорбції C. коагуляції D. когезії E. змочуванню
3. Макромолекули захисних білків (імуноглобулінів) адсорбуються своїми полярними групами на поверхні клітин бактерійних, що потрапляють в живий організм, і утворюють агрегати з більшого числа часток. Дисперсна система припиняє своє існування, тому що в результаті укрупнення часток відбувається їх
A. седиментація B. дифузія C. диспергування D. пептизація E. набрякання
4. На етикетках деяких лікарських препаратів є напис: "перед вживанням збовтувати". Це попередження викликане:
A. нерозчинністю дисперсних систем B. стійкістю дисперсних систем C. розчинністю дисперсних систем D. нестійкістю дисперсних систем E. нічим з перерахованого
5. Протаргол і коларгол можуть змінювати свою структуру з часом і втрачати агрегатну стійкість при злипанні часток дисперсної фази, цей процес називається:
A. гелеутворенням B. седиментацією C. набряканням D. пептизацією E. коагуляцією
6. Який потенціал обумовлює стійкість колоїдних систем?
A. Термодинамічний B. Хімічний C. електрокінетичний D. Дифузний потенціал E. Електродний
7. Золь - одна з лікарських форм. При зливанні золів з протилежно зарядженими гранулами відбувається:
A. підвищення седиментаційної стійкості B. взаємна коагуляція C. підвищення агрегативної стійкості D. седиментація E. колоїдний захист
8. Захисні білки - імуноглобуліни - сприяють злипанню бактерійних клітин, що потрапляють в організм людини і тварин, і їх знешкодженню. Це відбувається тому, що дисперсна система
A. Підвищує стійкість за рахунок укрупнення часток B. Втрачає стійкість за рахунок зменшення розміру часток C. Втрачає стійкість за рахунок укрупнення часток D. Підвищує стійкість за рахунок зменшення розміру часток E. Не змінює стійкості
Ситуаційні завдання до теми 8 «Стійкість та коагуляція дисперсних систем»: Завдання 1. За умов достатньо повільного введення речовини В в розбавлений розчин речовини А можливе утворення гідрозолю речовини С. Напишіть формулу міцели та визначте заряд колоїдних частинок золю, що утворився. Яка з рекомендованих речовин є найбільш економічно обгрунтованим коагулянтом цього золю?
* Ac – іон СН3СОО-
ТЕМА 9. ФІЗИКО-ХІМІЯ ВМР. Конкретні цілі: 1. Поняття про ВМР, методи їх одержання і класифікація. Структура макромолекул, типи зв'язку між ними. Гнучкість макромолекул. Кристалічний та аморфний стан ВМР. Пружно-твердий, високоеластичний та пластичний стан полімерів. Зв'язок між будовою і механічними властивостями полімерів. 2. Набрякання і розчинення ВМР. Вплив різних факторів на величину набрякання. Ліотропні ряди. 3. В’язкість розчинів ВМР. Методи визначення в’язкості. Рівняння Ейнштейна, Бінгама, штаудінгера. Віскозиметричний метод визначення молекулярної маси полімерів. 4. Осмотичний тиск розчинів ВМР. 5. Поліелектроліти. Ізоелектрична точка і методи її визначення. 6. Мембранна рівновага Доннана, її значення для вивчення транспорту лікарських речовин у клітини організму. 7. Драглі (гелі) та їх властивості. Драглювання (желатинування): швидкість, механізм. Тіксотропія. Висолювання. Коацервація. Синерезис. Джерела інформації: 1. Физическая и коллоидная химия / Под ред. В.И.Кабачного, - Харьков: Изд-во НФаУ, 2005, с. 312-328. 2. Физическая и коллоидная химия: Учебн. Для фарм. Вузов и факультетов / Под ред. К.И.Евстратовой.- М.: Высш. шк., 1990, с. 460-474.
Тестові завдання до теми 9 «Фізико-хімія ВМР»: 1. Синтетичні високомолекулярні сполуки - контактні лінзи, які застосовують замість окулярів, - набрякають у вологому середовищі очей. Набряклий матеріал лінз містить певну кількість води(не більше і не менше), яка потрібна для надання матеріалу характерних оптичних властивостей. Це приклад:
A. необмеженого набрякання B. адгезійного набрякання C. синтетичного набрякання D. кінетичного набрякання E. обмеженого набухання
2. У ізоелектричній точці для розчинів високомолекулярних сполук:
A. відсутні заряджені полярні угрупування B. відсутній дифузний шар C. сумарний позитивний заряд полярних угрупувань дорівнює сумарному негативному заряду(потенціал дорівнює нулю) D. відбувається руйнування структури макромолекули E. нічого з перерахованого
3. Розчини високомолекулярних сполук (ліпофільних колоїдів) отримують:
A. прямим розчиненням дисперсної фази в дисперсійному середовищі B. механічним дробленням часток дисперсної фази C. конденсаційними методами D. ультразвуковим дробленням E. жодним з перерахованих методів
4. Стійкість розчинів високомолекулярних речовин порушується при додаванні до них різноманітних електролітів. Ефект, що висолює, залежить головним чином від:
A. тривалої дії B. рівня гідратації іонів C. швидкості руху іонів D. температури E. молекулярної маси електролітів
5. За яких умов обмежене набрякання желатину переходить в необмежене(створення розчину)
A. при охолодженні B. при нагріванні C. у присутності іонів SO42- D. у присутності іонів Cl‾ E. у рН середовищі, яке відповідає ізоелектричній точці
6. Ізоелектрична точка міозину м'яза дорівнює 5. При яких значеннях рН електрофоретична рухливість міозину дорівнює нулю?
A. 2,0 B. 7,0 C. 4,0 D. 7,0 E. 5,0
7. α-амінокислоти - структурні одиниці білків. За своєю природою вони являються: A. неіногенними B. тільки катіонними електролітами C. тільки аніонними електролітами D. амфолітами E. нічого з перерахованого
Ситуаційні завдання до теми 9 «Основні поняття про ВМР»: Завдання 1. Білок плазми крові людини (альбумін) має молекулярну масу 69000. Розрахуйте осмотичний тиск розчину, який містить 2 г цього білку в 100 мл розчину при 25 0С. 4. ВІДПОВІДІ НА ТЕСТОВІ ЗАВДАННЯ ТЕМА 1 «Хімічна термодінамика». 1. С 2. С 3. Д 4. Е 5. А 6. Д 7. С 8. Е 9. С 10. В 11. Д
ТЕМА 2 «Хімічна кінетика та рівновага». 1. В 2. Е 3. Е 4. С 5. С 6. Д 7. А 8. Д 9. А 10.А
ТЕМА 3 «Розчини». 1. С 2.В 3.В 4.В 5.С 6. Д 7. С 8. Д 9. С 10. А
ТЕМА 4 «Електрохімія». 1.В 2.Д 3.С 4. А 5.В 6.Е 7.А 8.Д 9. A
ТЕМА 5 «Фізико-хімія поверхневих явищ». 1.А 2.Е 3.Д 4.С 5.А 6.А 7.С
ТЕМА 6 «Загальна характеристика дисперсних систем. Класифікація, отримання та очищення дисперсних систем». 1.А 2.Е 3.Д 4.А 5.В 6.А 7.Е 8.А 9.А 10.А
ТЕМА 7 «Молекулярно-кінетичні, оптичні та електричні властивості дисперсних систем». 1.Д 2.С 3.А 4.С 5.В 6.Д 7.А 8.А
ТЕМА 8 «Стійкість та коагуляція дисперсних систем». 1.Д 2.С 3.А 4.Д 5.Е 6.С 7.В 8.С
ТЕМА 9 «Фізико-хімія ВМР». 1.Е 2.С 3.А 4.В 5.В 6.Е 7.Д
5. ПРИКЛАД РОЗВ’ЯЗУВАННЯ СИТУАЦІЙНОГО ЗАВДАННЯ Тема1 «Хімічна термодінамика» Завдання 1. Розрахуйте тепловий ефект реакції
при 600 К, якщо стандартні теплоти утворення газоподібного етанолу, етилену та води дорівнюють відповідно: -234,80; -52,30; -241,81 кДж/моль, а молярні теплоємності описуються рівняннями:
Розв’язання Розраховуємо тепловий ефект реакції при стандартних умовах за наслідком із закона Гесса
Тепловий ефект при 600 К розраховуємо за рівнянням Кірхгофа
Враховуючи залежності
Підставляємо значення
Завдання 2. Гексаметилентетрамін (уротропін) отримують за реакцією
За відповідними значеннями стандартними ентальпії утворення та ентропій
Розрахуйте зміну енергії Гіббса в результаті реакції і визначте напрям реакції. Розв’язання Зміну ентальпії
Зміну енергії Гіббса реакції можна розрахувати за рівнянням Гіббса-Гельмгольца
Враховуючи, що
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 236; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.171.180 (0.115 с.) |



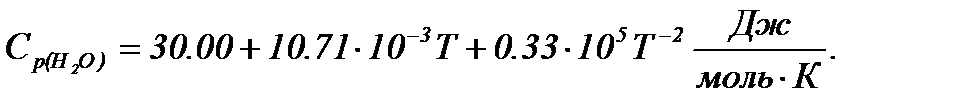



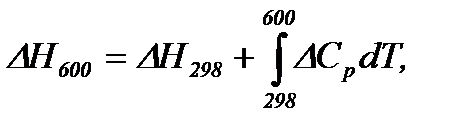

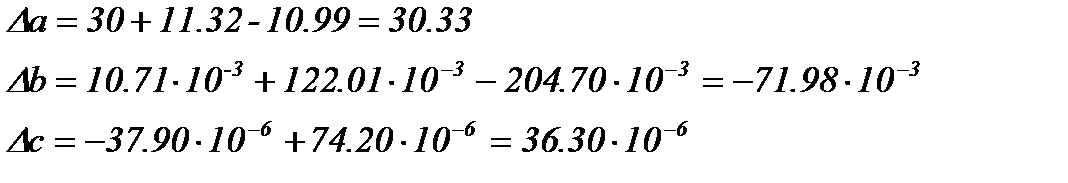


 .
. і
і  та інтегруємо рівняння Кірхгофа, маємо
та інтегруємо рівняння Кірхгофа, маємо



 і ентропії
і ентропії  при стандартних умовах можна розрахувати за наслідком із закону Гесса
при стандартних умовах можна розрахувати за наслідком із закону Гесса



 ,
,  – стандартна теплота і ентропія утворення вихідних речовин та продуктів реакції.
– стандартна теплота і ентропія утворення вихідних речовин та продуктів реакції.
 .
.



 < 0, то реакція протікає самодовільно в прямому напрямку.
< 0, то реакція протікає самодовільно в прямому напрямку.


