Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Потенциометрические методы анализаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Потенциометрия — это совокупность физико-химических методов анализа, основанных на измерении эдс специально составленных гальванических элементов. Электрохимические методы исследований широко применяются в клиническом анализе и в практике санитарно-гигиенических исследований. Так, с помощью потенциометрических методов возможно определение концентрации физиологически активных ионов (Н+, К+, Na+, Ca2+, Cl-, Br-) в биологических жидкостях и тканях. При применении специальных электродов возможно определение глюкозы, мочевины, аминокислот и других метаболитов, а с помощью газовых электродов можно вести контроль над состоянием воздушной среды. Различают потенциометрию двух видов: (а) прямая потенциометрия: например, определение рН различных биологических жидкостей. (б) косвенная потенциометрия; к ней относят различные формы потенциометрического титрования. Типы электродов, применяемых в потенциометрии 1) Электрод 1-го рода — это металл, опущенный в раствор своей соли. Например, Cu0/ Cu2+aq; Zn0/ Zn2+aq. Для электродов 1-го рода уравнение Нернста записывается следующим образом:
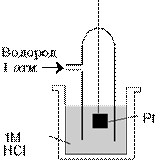
где Men+ — потенциалопределяющий ион. 2) Электрод 2-го рода — это металл, покрытый слоем своего труднорастворимого соединения и опущенный в раствор соли. Самым распространенным электродом этого вида является хлорсеребряный электрод, состоящий из серебряной проволоки покрытой слоем соли AgCl и опущенной в насыщенный раствор KCl. Схема хлорсеребряного электрода: Ag, AgCl / KCl (нас). При его работе протекает ОВ полуреакция: AgCl + е- Потенциал данного электрода рассчитывается по уравнению: φ= φo – 0,0592 lg [Cl‾]. 3) Газовые электроды — это электроды, в которых газы выступают в роли окислителей или восстановителей. Важнейшим является водородный электрод, состоящий из платиновой пластинки, опущенной в раствор соляной или серной кислоты. Водород, подаваемый в раствор под давлением 1 атм, адсорбируется на платине (рисунок 16).
Рисунок 16. — Устройство водородного электрода Pt, H2/2H+aq
При работе электрода протекает следующая полуреакция: 2 H+ + 2е- Рассчитать ОВ потенциал водородного электрода можно по уравнениям: φ=φo + 0,0592·lg [H+] или φ = – 0,0592 pH, т.к. стандартный потенциал водородного электрода принят равным нулю (φo = 0). 4) Ионоселективные электроды (ИСЭ) — это электроды, позволяющие определять содержание определенного иона в исследуемом растворе, содержащем смесь различных ионов. Примером является стеклянный электрод с водородной функцией, применяемый для потенциометрического определения pH растворов (рисунок 17). Главной частью данного электрода является стеклянная мембрана, проницаемая только для катионов водорода Н+. Внутри содержится миниатюрный хлорсеребряный электрод, выполняющий роль токовода.
Рисунок 17. — Устройство стеклянного электрода с водородной функцией
Схема стеклянного электрода с водородной функцией выглядит следующим образом: Ag, AgCl /HCl /стеклянная мембрана. Из-за различного содержания катионов водорода Н+ во внутреннем и исследуемом растворах на поверхности мембраны возникает потенциал, равный: φ = φo + 0,059 lg [H+] или φ = φo – 0,059 pH.
Потенциометрическое определение рН растворов Гальванический элемент, предназначенный для измерения pH, состоит из стеклянного электрода (измерительного) и хлорсеребряного электрода (вспомогательного): Ag, AgCl /HCl /стеклянная мембрана// Исслед. р-р/ KCl (нас.)/ AgCl, Ag
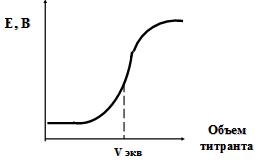
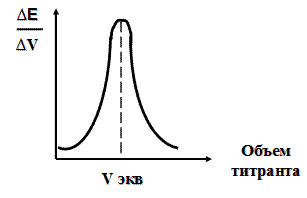
Стеклянный электрод с Хлорсеребряный водородной функцией электрод ЭДС данного гальванического элемента зависит от концентрации ионов H+ в исследуемом растворе. Величина ЭДС фиксируется при помощи потенциометра, называемого pH–метром. Потенциометрическое титрование — это любой метод титриметрического анализа, в котором точка эквивалентности фиксируется по резкому изменению эдс гальванического элемента, опущенного в исследуемый раствор. Определение точки эквивалентности выполняется графическим способом при помощи интегральной или дифференциальной кривых титрования (рисунок 18-19).
Рисунок 18. — Интегральная кривая потенциометрического титрования
Рисунок 19. — Дифференциальная кривая потенциометрического титрования Потенциометрические методы анализа позволяют: · анализировать окрашенные растворы, растворы с осадком и гели, · получать точные результаты в короткое время (экспресс-анализ), · исследовать состав биологических жидкостей человека без их разрушения, путем введения электродов в пораженные органы и ткани. Лекция 9 Химическая кинетика
Химическая кинетика — это раздел физической химии, изучающий скорость и механизм химических реакций. Кинетический метод исследования, наряду с термодинамическим и квантово-механическим, широко применяется в современном естествознании.
План 9.1. Понятие о скорости и механизме химических реакций. 9.2. Кинетические уравнения простых и сложных реакций. 9.3. Влияние температуры на скорость химических реакций.
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 903; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.007 с.) |

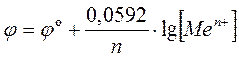
 Ag +Cl-.
Ag +Cl-.