
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные положения метода МО.Содержание книги
Поиск на нашем сайте
1. В образовании ковалентной связи участвуют все электроны в атоме. 2. Электроны в молекулах занимают молекулярные орбитали (MO), подобно тому, как в атомах они занимают атомные орбитали (AO). 3. Молекулярные орбитали заполняются электронами в соответствии с принципом минимальной энергии, принципом Паули и правилом Хунда. Молекулярные орбитали есть результат сложения или вычитания волновых функций атомных орбиталей взаимодействующих атомов. При сложении АО образуется связывающая МО, энергия, которой меньше энергии исходных атомных орбиталей. При вычитании АО образуется разрыхляющая МО, энергия, которой больше энергии исходных атомных орбиталей (рисунок 48).
Рисунок 48 ― Образование связывающей и разрыхляющей молекулярных орбиталей в результате сложения и вычитания 1s атомных орбиталей
Прочность двухатомных молекул определяется кратностью связи, которая рассчитывается по уравнению:
где N ― число электронов на связывающих орбиталях, N' ― число электронов на разрыхляющих орбиталях.
Молекула не образуется, если n = 0.
Метод МО позволяет определить магнитные свойства молекул. Парамагнитные молекулы -это молекулы, генерирующие электромагнитное поле. Они содержат неспаренные электроны на МО. Диамагнитные молекулы - это молекулы, не генерирующие собственное электромагнитное поле. Они не содержат неспаренных электронов на МО. Для описания молекул используются энергетические диаграммы.
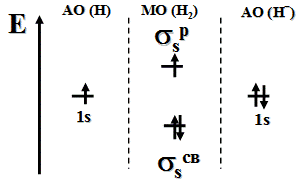
Энергетическая диаграмма молекулы H2
Молекула диамагнитна, так как не содержит неспаренных электроны на МО. Кратность связи равна единице:
Энергетическая диаграмма катиона H2+ Образование данного молекулярного иона можно представить как результат взаимодействия атома водорода и его катиона (H + H+).
Катион парамагнитен, так как содержит неспаренный электрон на МО. Кратность связи равна ½:
Энергетическая диаграмма аниона H2- Образование данного молекулярного иона можно представить как результат взаимодействия атома водорода и гидрид-иона (H + H-).
Анион парамагнитен, так как содержит неспаренный электрон на МО. Кратность связи равна ½:
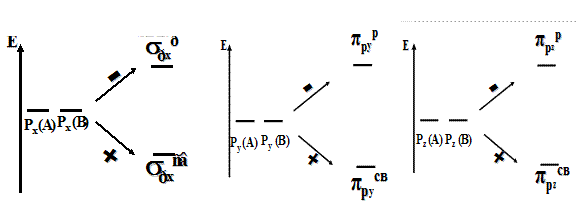
В образовании молекул, состоящих из атомов 2-го периода, участвуют молекулярные орбитали, полученные путем сложения и вычитания атомных орбиталей р-подуровня (рисунок 49).
(а) (б) (в) Рисунок 49 ― Образование связывающих и разрыхляющих молекулярных орбиталей в результате сложения и вычитания (а) px, (б) py и (в) pz атомных орбиталей.
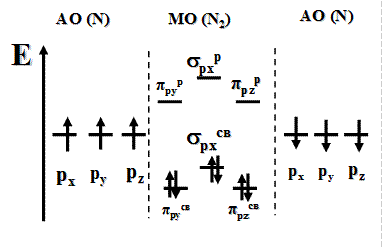
Энергетическая диаграмма молекулы N2
Молекула диамагнитна, так как не содержит неспаренных электронов на МО. Кратность связи равна трем:
Водородная связь
Водородная связь ― это особый вид меж- и внутримолекулярного взаимодействия, который описывается схемой: A - H•••В, где А и В – сильно электроотрицательные атомы: F, О, N, реже Сl и S. Механизм образования водородной связи состоит в том, что поляризованный атом водорода внедряется в электронную оболочку соседнего, ковалентно с ним не связанного, атома. Ввиду низкой прочности водородной связи, ее обозначают пунктиром или многоточием. Межмолекулярная водородная связь приводит к ассоциации молекул и существенно влияет на физические свойства веществ: tкип, tпл, растворимость и другие. Например, температура кипения родственных соединений растет с увеличением их молярной массы. Однако эта зависимость может нарушаться. Соединения с водородной связью имеют аномально высокие температуры кипения (рисунок 50).
Молярная масса
Рисунок 50 ― Зависимость температуры кипения Водородных соединений от их молярной массы Примеры соединений с межмолекулярной водородной связью Вода Во льду молекула Н2О образует четыре водородные связи, что формирует его трехмерную ажурную структуру (рисунок 51).
Рисунок 51― Структура льда
При плавлении льда часть водородных связей разрывается (при 20оС их сохраняется 46%) и молекулы воды заполняют пустоты в структуре льда. С этим связана аномалия плотности воды. Плотность льда меньше плотности жидкой воды (0,92 и 1,0 г/мл соответственно). Вследствие этого в зимнее время лед закрывает поверхность водоемов и, исполняя роль теплоизолятора, сохраняет в них жизнь. Ассоциацию молекул воды в жидкой фазе можно представить схемой:
Жидкая вода содержит как ассоциаты (кластеры), так и молекулы, не связанные водородными связями. Кластеры называют мерцающими (рисунок 52), т.к. среднее время их жизни составляет ~ 10-10 секунды.
Рисунок 52 ― Мерцающие кластеры жидкой воды
2) Фтороводородная кислота ••Н ¾ F ••• Н ¾ F ••• Н ¾ F •• 3) Спирты (R ¾ OH) •• Н ¾ О •••Н ¾ О ••• Н ¾ О •• ï ï ï R R R
(а) (б) Рисунок 53 ― Внутримолекулярные водородные связи, стабилизирующие (а) вторичную структуру белков, (б) вторичную структуру ДНК Лекция 13 Комплексные соединения
План 13.1. Основные понятия химии комплексных соединений (КС). 13.2. Строение КС. 13.3. Металло-лигандное равновесие в растворах. 13.4. Биологическая роль КС.
Основные понятия химии комплексных соединений (КС)
Комплексными (координационными) соединениями называют вещества, в структурных единицах которых число связей, образованных центральным атомом, превышает его высшую валентность.
Другое соединения кремния, Na2[SiF4], является комплексным, так как валентность кремния в нем равна шести:
Комплексные соединения состоят из: · комплексообразователей (металлов, реже неметаллов, таких как Si, P и др.); · лигандов (ионов или полярных молекул); · ионов внешней сферы (могут отсутствовать). Например,
В природе комплексных соединений больше, чем простых. Их изучение началось около 200 лет назад. Первой теорией комплексных соединений была координационная теория А. Вернера (1893). Важнейшей характеристикой комплексообразователя является его координационное число (к.ч.), т.е. число связей, образованных им с лигандами. Существует взаимосвязь между степенью окисления комплексообразователя и его координационным числом:
Важнейшей характеристикой лиганда является его дентантность ― число связей, образованных с комплексообразователем.
|
|||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1601; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.239.25 (0.006 с.) |


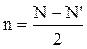 ,
,
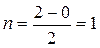

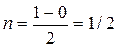





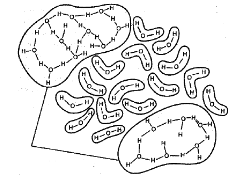
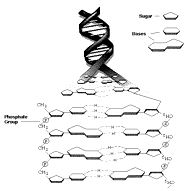 Значение внутримолекулярных водородных связей заключается в том, что они участвуют в формировании пространственных структур биополимеров (белков, нуклеиновых кислот, полисахаридов) (рисунок 53).
Значение внутримолекулярных водородных связей заключается в том, что они участвуют в формировании пространственных структур биополимеров (белков, нуклеиновых кислот, полисахаридов) (рисунок 53).
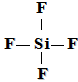 Например, соединение кремния SiF4 не является комплексным, так как валентность кремния в нем равна четырем, что соответствует высшей валентности данного элемента исходя из его положения в Периодической системе элементов.
Например, соединение кремния SiF4 не является комплексным, так как валентность кремния в нем равна четырем, что соответствует высшей валентности данного элемента исходя из его положения в Периодической системе элементов.





