
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция на твердых адсорбентахСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
К основным видам адсорбции на твердых адсорбентах относятся: · молекулярная адсорбция неэлектролитов и слабых электролитов, · избирательная адсорбция электролитов из их растворов, · ионообменная адсорбция. Молекулярной адсорбцией называют адсорбцию неэлектролитов и слабых электролитов из жидкой или газообразной фазы твердыми адсорбентами. Единой теории молекулярной адсорбции не существует, однако имеющиеся теории позволяют удовлетворительно описать адсорбционный процесс для конкретных случаев. Краткое описание трех теорий молекулярной адсорбции представлено в таблице 24.
Таблица 24 — Некоторые теории молекулярной адсорбции
Для вычисления молекулярной адсорбции используют эмпирическое уравнение Фрейндлиха: æ = kс1/n æ = kp1/n где æ — масса адсорбата на 1 грамме адсорбента, р — равновесное давление в газовой фазе, с — равновесная концентрация в жидкой фазе, k — константа Фрейндлиха, n — параметр уравнения. Определение параметров уравнения Фрейндлиха выполняют графическим способом. Построив график в логарифмических координатах lgk от lgc, находят логарифм константы Фрейндлиха как отрезок, отсекаемый на оси ординат. Тангенс угла наклона соответствует величине 1/n (рисунок 60).
Рисунок 60 — Определение параметров уравнения Фрейндлиха
Адсорбция электролитов из растворов бывает двух видов: (а) избирательная, (б) ионоселективная. Избирательная адсорбция электролитов описывается правилами Панета-Фаянса.
Правило 1: на твердой поверхности адсорбируются преимущественно те ионы, которые входят в ее состав. Такую адсорбцию можно рассматривать как достраивание кристаллической решетки адсорбента. Пример 1. Рассмотрим адсорбцию ионов на поверхности осажденного серебро (I) хлорида, получаемого в результате реакции ионного обмена AgNО3 + NaCl → AgCl (т) + NaNO3 На поверхности осадка AgCl могут адсорбироваться как катионы серебра Ag+, так и анионы хлора Cl-. Если в избытке находятся ионы серебра, то именно они адсорбируются на твердой поверхности. В результате поверхность приобретает положительный электрический заряд. Ионы, достраивающие кристаллическую решетку адсорбента, называют потенциалопределяющими ионами (ПОИ).
Если в избытке присутствуют ионы хлора, то они адсорбируются на поверхности раздела, придавая ей отрицательный электрический заряд: Правило 2: на заряженной поверхности адсорбируются ионы противоположного знака. Они называются противоионами (ПРИ). В результате адсорбции ПРИ на поверхности раздела формируется двойной электрический слой. Пример 2. На положительно заряженной поверхности серебро (I) хлорида, создаваемой катионами серебра, адсорбируются нитрат-ионы NO3-:
На отрицательно заряженной поверхности, создаваемой анионами хлора, адсорбируются катионы натрия Na+:
Способность ионов адсорбироваться на твердых поверхностях зависит: (а) от заряда иона; чем больше заряд, тем выше адсорбционная способность; (б) от ионного радиуса; чем меньше радиус, тем ниже адсорбционная способность. Ионы одного знака и заряда, но различной адсорбционной способности, образуют лиотропные ряды: Li+ Na+ K+ Rb+ Cs+
Cl‾ Br‾ NO3‾ I‾ CNS‾ OH‾
Ионообменная адсорбция — это процесс, в котором твердый адсорбент и раствор обмениваются одноименно заряженными ионами в эквивалентных количествах. Сорбенты, способные и обмену ионов, называются ионообменниками или ионитами. Различают два типа ионитов: катиониты и аниониты. Катиониты содержат подвижные катионы водорода H+ или металлов. К ним относятся алюмосиликаты, цеолиты, силикагели, целлюлоза и другие сорбенты. Механизм действия катионитов можно представить схемой:
R – H+(ТВ) + Na+(р-р) где R – органическая полимерная основа ионита. Аниониты содержат подвижные гидроксид-ионы OH-. К ним относятся основания Fe(OH)3, Al(OH)3 и некоторые другие сорбенты. Механизм действия анионитов можно представить схемой: R – OH-(ТВ) + Cl-(р-р) Иониты используются для обессоливания морской воды, а также для очистки сточных вод и фармакологических препаратов. В медицине они применяются для консервации крови, для беззондового определения кислотности желудочного сока, для детоксикации при отравлениях электролитами. Кроме того, аниониты используются как антацидные препараты, а катиониты применяются для лечения отеков, связанных с декомпенсацией сердечной деятельности. К ионному обмену способны ткани растений и животных. Карбоксильные и фосфатные группы обуславливают анионообменные свойства, аминогруппы – катионообменные свойства.
Адсорбционная терапия
Адсорбционная терапия – это клинический способ очистки организма от токсинов и других вредных веществ. В современной медицине твердые сорбенты применяются для проведения: гемо -, лимфо - и плазмо-сорбции, а также энтеросорбции. Гемо-, лимфо- и плазмосорбция — это методы очистки крови и других биологических жидкостей от токсинов путем их пропускания через колонки с активированным углем и другими сорбентами (применяется с 60-х годов 20 в.). Энтеросорбция — это метод лечения, основанный на связывании и выведении из ЖКТ токсичных веществ и аллергенов. Энтеросорбенты — это лекарственные препараты различной природы, осуществляющие связывание токсинов в ЖКТ путем адсорбции, ионного обмена и комплексообразования. Профессор Ю.М. Лопухин, внесший большой вклад в развитие адсорбционной терапии, считает, что «Будущее не за вводящей, а за выводящей медициной».
Хроматография
Хроматографический метод анализа (от греческого "хроматос" - цвет) разработан русским ботаником М. С. Цветом в 1903 г. М. С. Цвет установил, что зеленый пигмент растений хлорофилл состоит из нескольких веществ. При пропускании экстракта зеленого листа через колонку, заполненную порошком мела, и промывании ее эфиром, он получил несколько окрашенных зон, что свидетельствовало о наличии в экстракте нескольких веществ. Развитие хроматографических методов анализа началось в 30-е годы, когда возникла потребность в новом методе разделения и очистки веществ, разлагающихся при нагревании. Хроматография — это физико-химический метод разделения веществ, основанный на их распределении между двумя не смешивающимися фазами, одна из которых является неподвижной, а другая - подвижной. Неподвижная фаза представляет собой поверхностно-активное твердое тело или жидкость, закрепленную на поверхности инертного твердого носителя. Подвижная фаза – это газ или жидкость, которые проходят через слой неподвижной фазы. Вещество подвижной фазы непрерывно вступает в контакт с новыми участками сорбента и частично адсорбируется, а адсорбированное вещество контактирует со свежими порциями подвижной фазы и частично десорбируется. Таким образом, хроматография — это процесс, основанный на многократном повторении актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента.
Хроматографические методы анализа классифицируются либо по агрегатному состоянию фаз, либо по доминирующему механизму взаимодействия фаз (таблица 25).
Таблица 25 — Классификация по агрегатному состоянию фаз
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1132; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.107.223 (0.011 с.) |


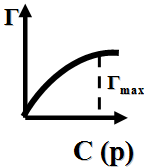 С концентрация адсорбата в растворе,
p - парциальное давление адсорбата
С концентрация адсорбата в растворе,
p - парциальное давление адсорбата
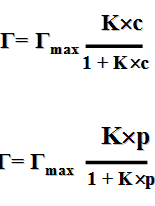 где К – константа адсорбционного равновесия
где К – константа адсорбционного равновесия







 Увеличение адсорбционной способности
Увеличение адсорбционной способности Увеличение адсорбционной способности
Увеличение адсорбционной способности R – Na+(ТВ) + H+(р-р),
R – Na+(ТВ) + H+(р-р),


