
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция на поверхности твердого телаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Адсорбция на твердом носителе имеет ряд особенностей, отличающих этот процесс от адсорбции на поверхности раздела фаз газ – жидкость. 1. Неоднородность твердой поверхности. 2. Адсорбция проходит не на всей поверхности, а на так называемых активных центрах, которые характеризуются ненасыщенностью связей. 3. Адсорбцию на твердой поверхности можно представить как обратимый квазихимический процесс. 4. Молекула вещества считается адсорбированной, если она находится в поверхностном слое в течение определенного времени, называемого временем адсорбции (обычно 10−12 – 10−5 с.). 5. Процессы адсорбции являются экзотермическими, поэтому с ростом температуры интенсивность адсорбции снижается. 6. Большинство применяемых сорбентов – это высокопористые тела с исключительно развитой поверхностью, достигающей сотни и тысячи м2/г. Адсорбенты поглощают тем больше вещества из объемной фазы, чем больше развита их поверхность. Поэтому адсорбирующую способность адсорбентов принято оценивать по их удельной поверхности, т.е. площади единицы массы адсорбента. 7. Частицы адсорбируемого вещества при адсорбции насыщают некоторую часть неуравновешенных частиц и, следовательно, понижают поверхностное натяжение. Поскольку при этом свободная энергия системы уменьшается, все адсорбционные процессы протекают самопроизвольно. 8. Если на поверхности адсорбента сорбируется только один слой молекул адсорбата, то адсорбция является мономолекулярной; при адсорбции большего числа слоев на поверхности – полимолекулярной. 9. При сорбции вещества из раствора необходимо учитывать, что последний является сложной многокомпонентной системой. При этом каждый компонент раствора теоретически способен взаимодействовать с сорбентом. Чем хуже сорбируется один компонент, тем лучше происходит адсорбция другого. 10. Количественной мерой адсорбции является избыточное (по сравнению с объемным) содержание компонента, измеряемое обычно в молях на квадратный метр поверхностного слоя сорбента:
где n s – количество сорбированного вещества; s – удельная поверхность сорбента, т.е. поверхность единицы массы сорбента. Для экспериментального исследования адсорбции на твердой поверхности применяют статический и динамический методы. Статические методы определения адсорбции из растворов сводятся к определению концентрации исходных растворов С 0, встряхиванию навески адсорбента ms в каждом растворе в течение времени, необходимого для установления адсорбционного равновесия, фильтрованию и определению равновесной концентрации растворенного вещества в фильтратах. Удельная адсорбция растворенного вещества
где С 0 и С * – соответственно исходная и равновесная концентрации сорбируемого вещества; V – объем раствора; ms – масса адсорбента. В этом случае удельная адсорбция представляет собой количество вещества, сорбированное площадью поверхности 1 кг сорбента. К числу динамических относится, например, фронтальный хроматографический метод, при котором раствор фильтруется через слой адсорбента, помещенного в колонку. В процессе сорбции отбираются пробы раствора, протекающего через колонку. При отборе проб, как правило, ориентируются на определенный объем раствора, пропущенного через сорбент. Например, пробы отбирают через 10 мл или через 50 мл. Процесс ведут до полного насыщения сорбента адсорбируемым веществом. По данным анализа строят так называемую выходную кривую в координатах концентрация раствора – объем фильтрата (см. рис. 14). Количество сорбированного вещества рассчитывают по формуле:
Изотерма адсорбции на твердой поверхности имеет вид, показанный на рис. 11. Удельная адсорбция увеличивается с ростом концентрации раствора. Для очень разбавленных растворов характер зависимости практически линейный. При сравнительно высоких концентрациях величина удельной адсорбции стремится к некоторому постоянному предельному значению Г∞, которое соответствует образованию на поверхности насыщенного мономолекулярного слоя сорбированных молекул. По величине предельной адсорбции можно дать количественную оценку удельной поверхности сорбента:
где N A – число Авогадро; SM – площадь поперечного сечения молекулы адсорбата (для карбоновых кислот она примерно составляет 20,5·10−20, для спиртов – 21,6·1020 м2). На среднем участке процесс адсорбции описывают либо при помощи уравнения Ленгмюра, либо эмпирическим уравнением Фрейндлиха
Уравнение Фрейндлиха имеет концентрационное ограничение применимости и используется для приблизительных расчетов удельной адсорбции на твердых сорбентах с неоднородной пористой поверхностью. Уравнение изотермы адсорбции Ленгмюра, выведенное на основании термодинамических и кинетических характеристик адсорбции хорошо согласуется с экспериментальными данными в области как низких, так и высоких концентраций раствора. При низкой концентрации (произведение KC << 1, соответственно 1 + KC ≈ 1) Г = Г∞ KC, получается линейная зависимость адсорбции от концентрации раствора как в области Генри. При высокой концентрации раствора KC + 1 ≈ KC значение адсорбции стремится к своему предельному значению. Однако и уравнение Фрейндлиха и Ленгмюра применимы только в случае образования мономолекулярного слоя адсорбтива. В случае полимолекулярной адсорбции изотерма адсорбции имеет более сложный характер. Для описания процесса применяют другие теории, например, БЭТ (Бруннауэра, Эммета и Тейлора), которую широко применяют при измерении удельной поверхности порошков и пористых материалов. Для проверки применимости того или иного уравнения изотермы адсорбции используют линейную форму уравнения. Если экспериментально полученные данные располагаются на этой прямой, то уравнение применимо. В этом случае возможно определить входящие в уравнение изотермы постоянные. Линейная форма уравнения Фрейндлиха определяется в логарифмических координатах lgГ = f (lgC):
Если при этом экспериментальные точки укладываются на прямую, то результаты опытов согласуются с уравнением Фрейндлиха. Отрезок ординаты, отсекаемый прямой равен lg a, а тангенс угла наклона – 1/ n. Приведение уравнения Ленгмюра к линейному виду возможно двумя способами: 1) При такой записи уравнения Ленгмюра график зависимости строят в координатах 1/Г – 1/ С. Свободный член полученного уравнения прямой равен 1/Г∞, а угловой коэффициент – 2) В этом случае график зависимости строят в координатах С /Г – С. Свободный член полученного уравнения прямой равен Ионообменная адсорбция Сущность ионообменного механизма заключается в стехиометрическом замещении ионов в твердой фазе на ионы из раствора. При донорно-акцепторном взаимодействии сорбент выступает в роли полимерного лиганда. Ионообменная адсорбция имеет ряд особенностей. 1. Сорбируются заряженные частицы (ионы). 2. Адсорбция идет только на полярных сорбентах. Отсюда ее другое название – полярная адсорбция. 3. Адсорбция сопровождается образованием двойного электрического слоя, состоящего из адсорбированных поверхностью ионов какого-либо вида и знака (потенциалопределяющих ионов) и связанных с ними электростатическими силами ионов противоположного знака (противоионов). Последние, находясь в динамическом равновесии с ионами раствора, являются подвижными и обмениваются на ионы того же знака, присутствующими в растворе. 4. В отличие от адсорбции молекул адсорбция ионов из растворов происходит избирательно: на данном сорбенте адсорбция ионов происходит не одинаково эффективно. 5. В основе ионной сорбции лежит химическое взаимодействие сорбента с сорбируемым веществом. Обмен противоионов происходит в строго эквивалентном отношении и может быть описан стехиометрическим уравнением. 6. Чем более полярным является сорбент, тем лучше он сорбирует оны из водных растворов. 7. Чем больше кристаллографический радиус иона при одинаковом заряде, тем лучше он сорбируется. По способности к адсорбции ионы располагаются в ряд (ряды Гедройца, Гофмейстера). Например, в ряду Li+ – Na+ – K+ – Rb+ – Cs+ – Mg2+ – Ca2+ – Sr2+ – Ba2+ –Al3+ – Fe2+ или Cl− – Br− – NO3− – I− – CNS− адсорбционная способность увеличивается. Ионный обмен широко распространен в природе и имеет большое практическое значение. Он характерен для многих твердых природных адсорбентов, таких как почвы, глины, силикагели, алюмогели, цеолиты (молекулярные сита), а также для специально синтезируемых полимерных материалов типа смол, называемых ионитами. Ионообменные смолы представляют собой зернистый материал с гранулами сферической или неправильной формы. Такие иониты состоят из пространственно «сшитых» углеводородных цепей (матриц) с жесткозакрепленными на них ионогенными группами – фиксированными ионами. Матрица полимера с фиксированными анионами представляет собой полианион, а катионами – поликатион. Заряд полииона нейтрализуется распределенными внутри полимера ионами противоположного знака (противоионами), которые могут вступать в реакцию обмена с ионами того же знака заряда, находящимися в растворе. Таким образом, если фиксированные ионы несут отрицательный заряд (-SO3-, -COO-, -PO32-, -AsO32-), то ионит способен к обмену катионов и является катионитом:
Если фиксированные ионы несут положительный заряд (-NH3+, =NH2+, [=N=]+, [-S=]+), то ионит способен к обмену анионов и является анионитом:
Чертой сверху принято обозначать твердую фазу сорбента. Главными характеристиками ионообменного процесса (и процесса сорбции вообще) являются коэффициент распределения, коэффициент селективности и константа ионного обмена. Коэффициент распределения определяется формулой:
где Коэффициент селективности определяется соотношением коэффициентов раствоределения целевого (i) и примесного (j) компонентов:
Константа ионного обмена характеризует избирательную способность ионита. В общем виде процесс ионного обмена можно записать как реакцию:
где R – матрица катионита или анионита; X и Y – обменные ионы; z – заряд иона раствора, заряд обменного иона ионита является единичным. Константа равновесия ионного обмена:
Для не очень строгих расчетов активности компонентов в фазе сорбента Для однозарядных обменных ионов можно записать следующее выражение константы равновесия с учетом того, что концентрация вещества в фазе сорбента определяется его адсорбцией:
которое называется уравнением Никольского. Основным критерием при оценке пригодности ионита для той или иной операции является его обменная емкость - число моль или эквивалентов вещества, поглощаемое единицей массы или объема смолы. Различают полную обменную емкость (ПОЕ), емкость до проскока или динамическую обменную емкость (ДОЕ) и статическую обменную емкость. ПОЕ характеризует общую поглотительную способность ионита, полученную в динамических условиях, до наступления насыщения. ПОЕ – величина, соответствующая концентрации в фазе сорбента функциональных групп, способных к ионному обмену Полную обменную емкость можно рассчитать, исходя из эквивалентной массы элементарного звена полимера, содержащего одну ионогенную группу. Однако для большинства ионитов, выпускаемых промышленностью, ПОЕ лишь приближается к расчетной величине. Это объясняется трудностью введения ионогенных групп при синтезе смол. ДОЕ определяется как величина емкости, которую можно усреднено приписать сорбенту по результатам определения объема профильтрованного через него раствора одного сорбируемого вещества определенной концентрации до его появления в фильтрате (до проскока). Обычно концентрацию проскока принимают равной ПДК. ДОЕ определяет технологические возможности сорбента. Определение емкости динамическим методом осуществляется в колонке, заполненной слоем ионита, через который медленно фильтруется раствор электролита известной концентрации. Габариты колонки, толщина слоя катионита, концентрация и состав рабочего раствора, скорость фильтрации и порядок отбора проб задаются исходя из конкретных исследовательских задач. При контрольном тестировании ионитов следует руководствоваться рекомендациями ГОСТов.
Рис. 14. Выходная кривая сорбции в динамических условиях
Полученная в результате эксперимента зависимость концентрации вещества в фильтрате от его объема называется выходной кривой (рис. 14). Емкость смолы в конкретных условиях сорбции, измеренная в статическом режиме в перемешиваемой системе, называется статической обменной емкостью (СОЕ). Значение СОЕ [% (по массе), или % (объемн.)] меньше полной обменной емкости. Многочисленные исследования показали, что процесс обмена противоионов включает в себя 5 последовательных стадий: 1) перемещение вытесняемого иона через пленку раствора, окружающую зерно, к его поверхности (пленочная, внешнедиффузионная кинетика); 2) перемещение вытесняющего иона внутри зерна к фиксированным ионам, т. е. к точке обмена (гелевая, внешнедиффузионная кинетика); 3) химическая реакция двойного обмена (химическая кинетика); 4) перемещение вытесняемого иона внутри зерна от точки обмена к поверхности; 5) перемещение вытесняемого иона через пленку раствора, окружающую зерно, вглубь раствора. Суммарная скорость многостадийного процесса определяется скоростью наиболее медленной стадии. Выявление этой стадии и является первым этапом изучения кинетики ионного обмена. Обычно рассматриваются не пять, а три стадии, поскольку первая и пятая, вторая и четвертая стадии являются однотипными и передают лишь разное по направлению перемещение обменивающихся ионов. Из трех стадий стадия двойного обмена определяется химической кинетикой – реакцией первого, второго и др. порядков; остальные две стадии носят диффузионный характер. Если скорость процесса не зависит от размера зерна ионита, то лимитирующей стадией является химическая кинетика. Зависимость скорости обмена от размера зерен ионита указывает решающую роль одного из диффузионных процессов. Поставив эксперимент по изучению зависимости скорости обмена от скорости перемешивания (статические условия) либо от скорости пропускания раствора (динамические условия)на ионитах с одинаковым временем контакта, можно установить, какой из диффузионных процессов (гелевый или пленочный) имеет решающее значение. Изменение скорости обмена от скорости перемешивания или пропускания раствора указывает на определяющую роль пленочной кинетики. Надежные сведения о том или ином механизме диффузии дает метод прерывания. Зерна ионита в определенный момент удаляют из раствора, а затем снова помещают в тот же самый раствор. В случае, если процесс определяется гелевой кинетикой, после перерыва скорость процесса становится более высокой, чем до прерывания процесса. Если процесс определяется пленочной кинетикой никакого изменения в характере выходной кривой не наблюдается. Контрольные вопросы 1. Что такое поверхностное натяжение? 2. Что такое поверхностная активность? 3. Как называются вещества, снижающие поверхностное натяжение? 4. Как влияет концентрация ПАВ в растворе на величину поверхностного натяжения? 5. Каково строение молекулы ПАВ? 6. Какие ПАВ называются ионогенными? 7. Чем объясняется резкое снижение величины поверхностного натяжения при увеличении концентрации ПАВ в растворе? 8. Что называют процессом сорбции? 9. Какими процессами определяется сорбционное равновесие? 10. Какими способами можно выразить величину адсорбции? 11. В каких координатах строится изотерма адсорбции? 12. Какие процессы соответствуют разным участкам изотермы адсорбции? 13. Какой процесс называют молекулярной адсорбцией? 14. Как изменяется поверхностное натяжение в процессе молекулярной адсорбции? 15. Какое основное термодинамическое уравнение применяется для описания процесса адсорбции на поверхности раздела фаз жидкость – газ? 16. От каких факторов зависит адсорбция на поверхности раздела фаз жидкость – газ? 17. Какое математическое уравнение соответствует правилу Дюкло-Траубе? 18. Как ориентированы молекулы ПАВ при адсорбции на поверхности раздела фаз жидкость – газ? 19. Чем определяется величина максимальная адсорбция молекул одного гомологического ряда? 20. Какая математическая формула соответствует уравнению Шишковского? 21. Каковы основные положения теории мономолекулярной адсорбции И. Ленгмюра? 22. Каково уравнение изотермы адсорбции Ленгмюра? 23. Каков физический смысл постоянных а и b уравнения Шишковского с позиции теории мономолекулярной адсорбции И. Ленгмюра? 24. Какие характеристики молекул ПАВ можно вычислить по величине предельной адсорбции? 25. Каковы особенности адсорбции на поверхности твердого тела? 26. Какова количественная мера адсорбции на поверхности твердого тела? 27. Какие методы применяют для экспериментального исследования адсорбции на твердой поверхности? 28. Какова сущность статического метода? 29. Какова сущность динамического метода? 30. Какими уравнениями возможно описание изотермы адсорбции на поверхности твердого тела? 31. Каким методом определяют применимость того или иного уравнения изотермы адсорбции? 32. В чем заключается сущность механизма ионообменной адсорбции? 33. Каковы особенности ионообменной адсорбции? 34. Что такое ионит? 35. Что представляет собой катионит, какие ионы сорбируются на катионите, какая реакция описывает сорбцию на катионите? 36. Что представляет собой анионит, какие ионы сорбируются на анионите, какая реакция описывает сорбцию на анионите? 37. Каковы главные характеристики ионообменного процесса? 38. Каковы основные характеристики ионита? 39. Какие стадии происходят при ионообменном процессе? 40. Каковы основные лимитирующие стадии ионного обмена?
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1412; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.013 с.) |

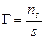 ,
,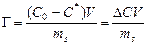 ,
,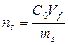 .
.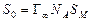 ,
, .
.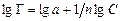 .
. .
.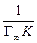 .
.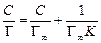 .
.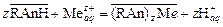 .
.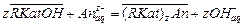 .
.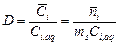 ,
,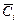 в – концентрация компонента в фазе сорбента, моль/кг; Сi – равновесная концентрация компонента в растворе, моль/кг;
в – концентрация компонента в фазе сорбента, моль/кг; Сi – равновесная концентрация компонента в растворе, моль/кг; 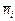 – количество вещества в фазе сорбента, моль; ms – масса сорбента, кг.
– количество вещества в фазе сорбента, моль; ms – масса сорбента, кг.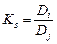 .
.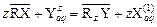 ,
,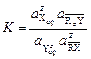 .
.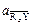 и
и  принимают равными концентрации вещества в твердой фазе.
принимают равными концентрации вещества в твердой фазе.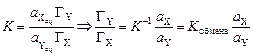 ,
,



