
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 4. Поверхностные явленияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Поверхностная энергия и поверхностное натяжение. Физическая и химическая адсорбция. Поверхностно-активные и поверхностно-инактивные вещества. Адсорбция на границе раздела фаз: жидкость-газ и жидкость-жидкость. Уравнение Гиббса. Адсорбция на границе твердое тело-газ и твердое тело-раствор. Уравнения Ленгмюра и Фрейндлиха. Молекулярная и ионообменная адсорбция. Иониты. Хроматография, виды, механизм. Хроматографический адсорбционный анализ. Применение хроматографии. Вещество в конденсированном состоянии обладает поверхностной энергией, обусловленной нескомпенсированностью силовых полей частиц на поверхности раздела фаз. Термин «поверхностная энергия» обычно используется применительно к границе раздела фаз газ − твердое тело. Для границы раздела жидкость – жидкость, жидкость – твердое тело применяют термин «межфазная энергия». Для границы раздела фаз жидкость – газ (пар) обычно используют термин «удельная (на 1 м2) поверхностная энергия», называемая поверхностным натяжением, которое равно работе образования единицы площади раздела фаз (Дж/м2). Обычно под поверхностной энергией понимается энергия Гиббса образования поверхности D G. Она равна произведению удельной поверхностной энергии σ на площадь поверхности раздела фаз S: D G = σ ·S. Удельная поверхностная энергия определяется природой вещества. Чем выше энергия взаимодействия между частицами вещества, тем выше удельная поверхностная энергия. Вследствие наличия поверхностной энергии на границе раздела фаз происходит накопление тех или иных частиц. Изменение концентрации вещества на границе раздела фаз называется адсорбцией. Адсорбция – это разновидность сорбции, т.е. поглощение одного вещества другими веществами. Если вещество поглощается всем объемом другого, то происходит абсорбция, если вещество концентрируется на поверхности раздела фаз, то имеет место адсорбция. Вещество, способное поглощать, адсорбировать другое, называется адсорбентом, вещество, которое может адсорбироваться – адсорбтивом, а адсорбированное вещество адсорбатом. Процесс, обратный адсорбции, называется десорбцией. По природе сил взаимодействия адсорбента с адсорбтивом различают адсорбцию физическую и химическую. Физическая адсорбция вызывается силами межмолекулярного взаимодействия (силами Ван-дер-Ваальса). Теплота физической адсорбции составляет 8,3-25,1 кДж/моль. Процесс физической адсорбции протекает быстро, так как не требует активации молекул. Химическая адсорбция осуществляется за счет химических сил межмолекулярного взаимодействия и называется хемосорбцией. Хемосорбция сопровождается взаимодействием адсорбента и адсорбтива и является практически необратимым процессом. Тепловой эффект хемосорбции сопоставим с тепловым эффектом химических реакций и достигает 500 КДж/моль. Примером хемосорбции является адсорбция кислорода поверхностью активированного угля. При нагревании системы поверхности удаляется не О2 , а СО. Величину адсорбции (Г) выражают количеством вещества-адсорбата (n) на единицу поверхности адсорбента (S) или массы адсорбента (m). Вычисляют по формулам Г = Адсорбция может происходить на границе раздела: жидкость – газ; жидкость – жидкость; твердое тело − газ; твердое тело – раствор. Зависимость величины адсорбции от концентрации раствора устанавливает уравнение изотермы Гиббса, которое универсально с точки зрения термодинамики и применимо к границам раздела любых фаз: Г = - где Г –- величина адсорбции, моль/кг или моль/м2; С – концентрация раствора, моль/л; R – газовая постоянная; Т – абсолютная температура; dd/dC – мера поверхностной активности адсорбтива, (Дж×л)/(м×моль). Знак производной dd/dC указывает на характер зависимости. Адсорбция на границе твердое тело – раствор имеет сложный характер из-за физической неоднородности поверхности твердых тел. В процессе адсорбции участвует не только внешняя, но и внутренняя поверхность адсорбента. Кроме того, адсорбция из растворов на твердом адсорбенте осложняется наличием третьего компонента – среды, молекулы которой могут также адсорбироваться на его поверхности. Адсорбцию растворов средних концентраций и газов средних давлений на твердой поверхности описывает эмпирическое уравнение Фрейндлиха. Применительно к адсорбции растворов на твердом адсорбенте уравнение Фрейндлиха имеет вид Г = К × С где К – константа, при С = 1 моль/л К = Г; 1/ a – константа (адсорбционный показатель), зависит от природы адсорбента и температуры. 1/ a = 0,1−1. Более универсальной является теория межмолекулярной адсорбции Ленгмюра. Уравнение изотермы адсорбции Ленгмюра выведено на основании теоретических предпосылок и справедливо для широкого интервала концентрации и разных границ раздела фаз (жидкость – газ; жидкость – жидкость; твёрдое – газ; твёрдое – жидкость). Изотерма адсорбции Ленгмюра выражается уравнением Г = Гmax × где Г – величина адсорбции, моль/кг; Гmax – величина предельной адсорбции, моль/кг; С – концентрация раствора, моль/кг; В – константа равновесия адсорбции. Величина константы В зависит от природы адсорбента и адсорбтива. При низких концентрациях адсорбция растёт линейно с увеличением концентрации. При высоких концентрациях (С>>В) значением В в знаменателе можно пренебречь, тогда Г = Гmax. Это означает, что с увеличением концентрации адсорбция достигает предельного значения (Гmax). На способности избирательного и последовательного поглощения адсорбентами растворенных веществ основывается хроматография – метод разделения и анализа многокомпонентных смесей. Разделение веществ основано на различном распределении их между двумя фазами – неподвижной и подвижной (элюентом). Неподвижной фазой является сорбент с развитой поверхностью, а подвижной – поток газа или жидкости, который фильтруется через слой сорбента или перемещается вдоль сорбента. По механизму разделения компонентов различают хроматографию адсорбционную, распределительную, ионообменную и осадочную. В зависимости от агрегатного состояния элюэнта (подвижной фазы) различают газовую и жидкостную хроматографию. По способу разделения различают хроматографию колоночную, капиллярную, тонкослойную, бумажную. В зависимости от ввода пробы и способа перемещения хроматографических зон по слою сорбента различают хроматографию проявительную (или элюентную), фронтальную и вытеснительную. Наиболее часто применяется проявительная хроматография. В этом варианте хроматографии анализируемую смесь периодически вводят в поток подвижной фазы. В колонке смесь разделяется на отдельные компоненты, образуя слои (или зоны). Во фронтальном варианте разделяемую смесь непрерывно подают в колонку, часто вместе с подвижной фазой. В этом случае в чистом виде получают только один наименее сорбируемый компонент. Остальные зоны содержат два и большее число компонентов смеси. Полное разделение смеси на отдельные компоненты происходит при многократном повторении хроматографирования. В вытеснительном варианте хроматографии в колонку после подачи разделяемой смеси вводят специальное вещество (вытеснитель), которое адсорбируется лучше любого из компонентов смеси. Разделяемые вещества при этом образуют отдельные зоны.
В качестве адсорбентов используют многие твердые вещества: активированный уголь, оксид алюминия, силикагель, кремниевую кислоту, сахарозу, крахмал, различные полимеры. Адсорбционную хроматографию проводят в хроматографической колонке (трубка, заполненная адсорбентом). При пропускании через колонку разделяемой смеси ее компоненты адсорбируются в порядке убывания их сродства к адсорбенту. Вследствие различной сорбционной способности компоненты разделяемой смеси распределяются в адсорбенте слоями, образуя отдельные зоны. При продолжительном пропускании элюэнта через колонку компоненты выходят с потоком элюэнта в определенной последовательности: первым − компонент с минимальным сродством к адсорбенту, последним – с наибольшим. Если адсорбируемые вещества окрашены, то в хроматографической колонке образуется несколько окрашенных зон, получается хроматограмма. По характеру хроматограммы можно судить о составе анализируемой смеси. Если адсорбируемые вещества бесцветны, то их можно обнаружить, пропустив через колонку специальный реактив, образующий с этими веществами окрашенные продукты реакции. Такой процесс называют «проявлением» хроматограммы, а используемый реактив – проявителем. Распределительная хроматография основана на распределении компонентов смеси между двумя жидкими фазами, не смешивающимися друг с другом, – неподвижной и подвижной. Неподвижная фаза находится в порах адсорбента носителя, помещенного в колонку. Для разделения анализируемой смеси ее вводят в колонку, в которой компоненты перемещаются с помощью подвижной фазы. При этом происходит перераспределение компонентов смеси между двумя фазами в соответствии с коэффициентом распределения, который вычисляется по формуле К = где Сп.ф. – концентрация компонента в подвижной фазе, моль/л; Сн.ф. – концентрация компонента в неподвижной фазе, моль/л. Ионообменная хроматография – это жидкостная хроматография, основанная на различной способности разделяемых ионов к ионному обмену с ионами сорбента. Сорбенты, применяемые в ионообменной хроматографии, называют ионитами. Иониты – полимерные вещества, содержащие ионогенные группы, способные к обмену ионов при контакте с растворами электролитов. Большинство ионитов – твердые нерастворимые полиэлектролиты аморфной или кристаллической структуры. Их основу составляет молекулярный каркас (матрица), на котором закреплены ионогенные группы. По знаку заряда подвижных ионов различают катиониты (органические кислоты), аниониты (основания) и амфотерные иониты (амфолиты). Катионы обычно содержат в своих молекулах группы: –Н, −SO3H, −COOH; аниониты: (−NH2), (=NH). Ионообменный процесс на катионите происходит по схеме:
Для разделения катионов используют катиониты и в качестве элюента – растворы кислот. Анионы разделяют с помощью анионитов, а в качестве элюэнта используют растворы щелочей. Реакция обмена ионов обратима, что позволяет регенерировать иониты. Осадочная хроматография основана на различной растворимости осадков, образующихся при взаимодействии компонентов анализируемой смеси с реагентом-осадителем. При этом анализируемая смесь находится в подвижной фазе, а осадитель – в неподвижной. В качестве сорбентов используют силикагель, оксид алюминия, целлюлозу, крахмал, уголь, иониты, а в качестве подвижной фазы – чистый растворитель или растворы, в которых растворимость осадков разного состава различна. Для разделения смеси требуется многократное повторение процессов образования и растворения осадков. Осадочная хроматография применяется для анализа неорганических и органических веществ, образующих с осадителем и элюентом осадки различной растворимости. Задания для выполнения контрольной работы 225. Особенность поведения веществ на границе раздела фаз. 226. Что такое адсорбция? Виды адсорбции. Факторы, влияющие на процессы адсорбции. 227. Уравнение Гиббса, его анализ. 228. Изотерма адсорбции, типы изотерм адсорбции. 229. Поверхностно-активные вещества (ПАВ), особенности строения молекул. Примеры применения ПАВ. 230. Изотерма адсорбции Фрейндлиха. Области применения адсорбции. 231. Понятие об ионообменной адсорбции. 232. Значение сорбционных процессов в биологических системах. 233. Сущность методов хроматографии, их классификация. 234. Молекулярно-адсорбционная хроматография. 235. Сущность распределительной хроматографии. 236. Ионообменная хроматография. 237. Сущность осадительной хроматографии. 238. Методика разделения смеси ионов. 239. Жесткость воды, её устранение ионообменной хроматографией. 240. Практическое значение хроматографии.
Тема 5. Коллоидная химия Классификация дисперсных систем. Дисперсионная среда и дисперсная фаза. Оптические, кинетические, электрические свойства коллоидных систем. Теория мицеллообразования. Способы получения дисперсных систем (диспергирование, коагуляция). Виды устойчивости коллоидных систем. Разрушение коллоидных систем. Коагуляция. Правило Шульце-Гарди. Порог коагуляции. Коллоидная защита, ее роль в биологических системах. Специфические особенности растворов ВМС, их классификация. Сходство ВМС с истинными растворами и коллоидными системами. Растворение ВМС, набухание. Вязкость растворов ВМС. Изоэлектрическая точка белка. Устойчивость растворов ВМС. Высаливание. Коацервация. Предметом изучения коллоидной химии являются высокодисперсные микрогетерогенные системы, состоящие из дисперсной фазы, равномерно распределенной в твердой, жидкой или газообразной дисперсионной среде. Дисперсная фаза обладает высокой дисперсностью, и чем мельче частицы, тем выше степень дисперсности. Степень дисперсности – это величина, обратная размеру (диаметру) дисперсной частицы. Она определяется по формуле: D =1/ a, где D – степень дисперсности, м-1; a – диаметр частицы. Классификацию дисперсных систем проводят на основании различных признаков: размера частиц, агрегатного состояния дисперсной фазы и дисперсионной среды, характеристик взаимодействия частиц. По степени дисперсности системы подразделяют на три типа: 1. Молекулярные или ионные растворы: а < 10 -9 м. Частицы этих систем представляют собой молекулы или ионы, а сами системы являются истинными растворами, обладающими и кинетической, и термодинамической устойчивостью. 2. Коллоидные системы: а =10 -7 - 10 -9 м. Это системы с хорошо развитой поверхностью раздела между фазами. Их частицы не оседают под действием силы тяжести, проходят через бумажные фильтры, но задерживаются растительными и животными мембранами. Благодаря малому размеру частиц и их непрерывному движению, эти системы кинетически устойчивы. Важной особенностью коллоидных систем является их высокая агрегативная устойчивость, которая проявляется в способности системы сохранять постоянной во времени степень дисперсности. Этот тип устойчивости связан с наличием на поверхности частиц двойного ионного и адсорбционно-сольватного слоев. Первый из них обусловливает электростатическое отталкивание одноименно заряженных частиц, а второй препятствует соприкосновению частиц и их слипанию. Однако, являясь высокодисперсными гетерогенными системами с высокоразвитой поверхностью раздела фаз, они обладают избытком поверхностной энергии, что объясняет их термодинамическую неустойчивость. Коллоидные системы прозрачны, рассеивают свет (опалесцируют). 3. Грубодисперсные системы: а >10 -7 м. Эти системы кинетически неустойчивы, под действием силы тяжести расслаиваются на две фазы. К таким системам относят: а) суспензии − взвеси глины, крахмала, муки, дрожжей в воде, холодное молоко; б) эмульсии − масло в воде, вода в нефти; в) пены – пивная, мыльная, противопожарная; г) дымы; д) пыли – сахарная, мучная, цементная и др. Таким образом, коллоидные системы, называемые иначе золями, занимают промежуточное положение между истинными растворами и грубыми дисперсиями. По кинетическим свойствам дисперсной фазы дисперсные системы подразделяют на два класса: 1) свободнодисперсные – системы, в которых частицы дисперсной фазы не связаны между собой и могут свободно перемещаться (лиозоли, суспензии, эмульсии); 2) связанодисперсные – системы, в которых одна из фаз закреплена и не может перемещаться свободно (гели, студни, пены). По характеру взаимодействия частиц дисперсной фазы и дисперсионной среды коллоидные системы делят на две группы: лиофильные и лиофобные. Лиофобными называют коллоидные системы, у которых дисперсная фаза слабо взаимодействует с дисперсионной средой. К ним относятся золи сульфидов мышьяка, сурьмы, кадмия, золи благородных металлов. Лиофильными называют коллоидные системы, в которых дисперсная фаза активно взаимодействует с дисперсионной средой. Лиофильные коллоиды образуются при самопроизвольном растворении веществ в соответствующих растворителях. К ним относятся водные растворы белков, целлюлозы, крахмала, растворы каучуков в жидких углеводородах. По агрегатному состоянию дисперсной фазы и дисперсионной среды можно выделить следующие типы дисперсных систем (табл.).
Таблица
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 712; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.54.188 (0.009 с.) |

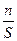 или Г =
или Г =  .
. ×
× 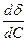 ,
, ,
, ,
,
 ,
,


