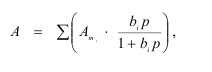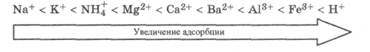Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химия поверхностных явленийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Поверхностные явления и их значение в биологии и медицине. Поверхностно-активные и поверхностно-неактивные вещества. Примеры.
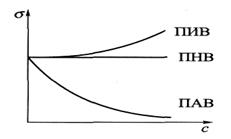
Поверхностные явления возникают в гетерогенных системах. На поверхности раздела фаз наблюдаются различные поверхностные явления: поверхностное натяжение, сорбция, смачивание, капиллярная конденсация. Живые организмы представляют собой системы с очень развитыми поверхностями раздела(кожные покровы, стенки кровеносных сосудов и нервных окончаний, клеточные мембраны и т.д.). Все жизненно важные процессы в организме происходят на поверхности биологических мембран, поэтому для понимания их механизма и патологических изменений, связанных с проницаемостью клеточных мембран, важно знать закономерности, которым подчиняются поверхностные явления. Поверхностно-активные вещества (ПАВ) – это вещества, которые понижают поверхностное натяжение растворителя. (спирты, карбоновые кислоты, альдегиды, мыла, белки и др.) Поверхностно-неактивные вещества(ПНВ) – вещества, практически не изменяющие поверхностное натяжение растворителя. (сахароза).
2. Поверхностная энергия и поверхностное натяжение. Изотерма поверхностного натяжения. Поверхностная активность. Правило Дюкло-Траубе.
Свободная поверхностная энергия – это термодинамическая функция, которая характеризует энергию межмолекулярного взаимодействия частиц на границе раздела фаз с частицами контактирующих фаз. СПЭ равна: Gs= σ*S, Где Gs - свободная поверхностная энергия системы, Дж; S – площадь межфазной поверхности, м2; σ – коэффициент поверхностного натяжения или просто поверхностное натяжение, Дж/м2. Gs при постоянном давлении совпадает с термодинамической функцией – энергией Гиббса. Поскольку все самопроизвольные процессы в соответствии со 2-ым началом термодинамики идут в направлении уменьшения энергии Гиббса, поэтому и свободная поверхностная энергия системы самопроизвольно стремиться к минимуму. Для однокомпонентных жидкостей это осуществляется путём уменьшения площади поверхности раздела фаз. В растворах Gs может понижаться путём снижения поверхностного натяжения в поверхностном слое жидкости.
Поверхностное натяжение – это энергия Гиббса единицы поверхности. Она равна работе, необходимой для образования единицы поверхности раздела фаз при постоянной температуре. (Дж/м2 или Н/м) Поверхностное натяжение зависит: 1. От температуры (с увеличением температуры поверхностное натяжение уменьшается); 2. От природы жидкости; 3. От давления (с увеличением давления поверхностное натяжение уменьшается, т.к. сила Fм уменьшается) Молекула в объёме жидкости испытывает одинаковое притяжение со всех сторон и равнодействующая молекулярных сил (FM)=0. На границе фаз молекула имеет притяжение только со стороны жидкости. Оно не компенсируется со стороны газообразной фазы. Здесь FM не равно нулю и направлена в глубь жидкой фазы. Притяжение поверхностных молекул жидкости определяется внутренним давлением данной жидкости. Pвнутр – это сила притяжения между молекулами жидкости в её объёме. При выходе молекул на поверхность совершается работа Ws против этой силы. В результате возникает поверхностный слой с избыточной свободной поверхностной энергией. 4. От разности полярности (∆П) фаз в системах жидкость-газ и жидкость-жидкость (правило Ребиндера): Чем больше ∆П фаз, тем больше поверхностное натяжение на их границе раздела. 5. От природы и концентрации растворенных веществ. (Вещества могут уменьшать, увеличивать и не влиять на поверхностное натяжение растворителя.)
Зависимость поверхностного натяжения при постоянной температуре от концентрации растворённого вещества называется изотермой поверхностного натяжения.
Поверхностная активность(g) – способность растворённых веществ изменять поверхностное натяжение растворителя/
Правило Дюкло-Траубе: в гомологическом ряду при увеличении длины углеводородного радикала на одну группу -СΗ2 поверхностная активность вещества увеличивается в среднем в 3 раза. Поверхностная активность зависит от строения молекул ПАВ; последние обычно состоят из полярной части (группы, обладающие большим дипольным моментом) и неполярной части (алифатические или ароматические радикалы). В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3 раза при увеличении углеродного радикала на одну -СΗ2-группу.
3. Адсорбция на границе раздела фаз жидкость – газ и жидкость – жидкость. Уравнение Гиббса. Ориентация молекул в поверхностном слое и структура биологических мембран.
Сорбция - самопроизвольный процесс поглощения твёрдым телом или жидкостью веществ из окружающей среды. Десорбция – процесс обратный сорбции. Адсорбция – это самопроизвольное изменение концентрации растворённых веществ на границе раздела фаз. При адсорбции происходит ориентация ПАВ в поверхностном слое. Если концентрация ПАВ маленькая, то они занимают горизонтальное положение, достаточная – вертикальное. Адсорбция зависит: 1. От температуры 2. От природы растворённого вещества(на поверхности накапливается вещество с меньшим поверхностным натяжением.) 3. От концентрации. Абсорбция – это поглощение газа или пара всем объёмом твёрдого вещества или жидкости. Сорбат – поглощаемое вещество, находящееся в среде. Сорбент – поглощающее твёрдое тело или жидкость. Адсорбция — это, в широком смысле, процесс изменения концентрации у поверхности раздела двух фаз.
Адсорбцию на границе раздела жидкость – газ вычисляют с помощью уравнения изотермы адсорбции Гиббса:
где С – молярная концентрация растворённого вещества,
R – газовая постоянна (8,31), T – температура, К. В гомологическом ряду ПАВ величина адсорбции изменяется по правилу Дюкло-Траубе. На границе раздела «жидкость – газ» снижение свободной поверхностной энергии происходит за счёт уменьшения поверхностного натяжения. При адсорбции на поверхности ПАВ это осуществляется путём их ориентации в поверхностном слое. Если концентрация ПАВ маленькая, то они занимают горизонтальное положение, достаточная – вертикальное. Образуется мономолекулярный слой (поверхностная плёнка) Лэнгмюра. Биологические мембраны состоят из молекул белков и фосфолипидов. Молекулы фосфолипидов расположены в два ряда — гидрофобными концами внутрь, гидрофильными головками к внутренней и внешней водной среде. В отдельных местах бислой (двойной слой) фосфолипидов насквозь пронизан белковыми молекулами (интегральные белки). Внутри таких белковых молекул имеются каналы — поры, через которые проходят водорастворимые вещества. Другие белковые молекулы пронизывают бислой липидов наполовину с одной или с другой стороны (полуинтегральные белки). На поверхности мембран эукариотических клеток имеются периферические белки. Молекулы липидов и белков удерживаются благодаря гидрофильно-гидрофобным взаимодействиям. 4. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор). Мономолекулярная и полимолекулярная адсорбция. Хемосорбция.
Адсорбция на твёрдой поверхности происходит потому, что она содержит «активные» центры. Это неровности (выступы), где силовые поля скомпенсированы частично. На поверхности есть участки с большим запасом свободной поверхностной энергии Гиббса, способные притягивать молекулы веществ, которые находятся в поверхностном слое.
Величина адсорбции газа или пара твёрдым адсорбентом зависит от следующих факторов: 1. Природы и площади поверхности адсорбента (адсорбент тем эффективнее, чем мельче измельчён и чем выше его пористость. В зависимости от природы адсорбенты подразделяются на неполярные (гидрофобные) – активированный уголь, тальк и полярные (гидрофильные) – силикагель, алюмогель, глины и др. 2. Природы поглощаемого газа(пара) (адсорбируемость газа или пара определяется его сродством к поверхности адсорбента.) 3. Концентрации или давления газа или пара (при увеличении концентрации, адсорбция увеличивается.) 4. Температуры.(С повышением температуры физическая адсорбция уменьшается, т.к. это процесс экзотермический.)
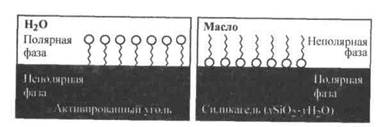
Существенное отличие адсорбции веществ из раствора от адсорбции из газовой фазы заключается в конкуренции между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Молекулярная адсорбция зависит от следующих факторов: 1) природы адсорбента; 2) природы растворителя; 3) природы поглощаемого вещества (адсорбата); 4) концентрации раствора; 5) температуры. 1. Влияние природы адсорбента на процесс молекулярной адсорбции из раствора определяется, как и в случае адсорбции газов, удельной поверхностью адсорбента и его сродством к поглощаемому веществу. Гидрофильные адсорбенты (силикагель, глины, пористые стекла) хорошо поглощают полярные вещества, а гидрофобные (сажа, активированный уголь) - неполярные вещества. 2. Природа растворителя должна сильно отличаться от природы растворенного вещества и природы адсорбента. Только в этом случае адсорбция вещества из раствора будет эффективной. Другими словами: Чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества. 3. Влияние природы поглощаемого вещества определяется несколькими правилами. Во-первых, правилом " подобное взаимодействует с подобным ", которое указывает на необходимость сродства между адсорбируемым веществом и адсорбентом. Во-вторых, правилом Н. А. Шилова: Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента. Это происходит из-за конкурентного характера молекулярной адсорбции из раствора, где концентрация растворителя всегда значительно больше, чем вещества в растворе. Поэтому из лиофильной системы прежде всего будет адсорбироваться растворитель, а не растворенное вещество. В-третьих, правилом выравнивания полярностей контактирующих фаз, сформулированным П. А. Ребиндером: На поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причем с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает. Поэтому эффективней всего адсорбируются вещества, молекулы которых дифильны, т. е. в их структуре четко выражено присутствие двух фрагментов: полярного (гидрофильного) и неполярного (гидрофобного). Дифильные молекулы принято изображать в виде "головастика"
Рис. 26.5. Ориентация дифильных молекул на поверхности адсорбента
4. Влияние концентрации растворенного вещества на процесс его адсорбции из раствора при постоянной температуре также описывается уравнением Ленгмюра. 5. При повышении температуры адсорбция веществ из растворов обычно уменьшается. Причинами этого являются ослабление взаимодействия между поглощаемым веществом и адсорбентом, а также улучшение растворимости вещества в растворителе. Молекулярная адсорбция из растворов на твердом адсорбенте широко используется в медицинской практике. Так, при отравлениях применяется активированный уголь, способный адсорбировать газы, алкалоиды, барбитураты, токсины из пищеварительной системы. Одна таблетка активированного угля массой 0,25 г имеет адсорбционную поверхность около 100 м2. В настоящее время при острых отравлениях активированный уголь обычно вводят в желудок. С его помощью осуществляют также сорбционную детоксикацию крови и лимфы больного путем перфузии (пропуская их через активированный уголь). При гемоилимфосорбции биологические системы очищаются от барбитуратов, дихлорэтана, фосфорорганических соединений, алкалоидов и токсинов. Однако активированный уголь необходимо импрегнировать, чтобы он не адсорбировал белки и форменные элементы крови и был совместим с кровью. В санитарно-гигиенической практике молекулярная адсорбция используется для очистки питьевой воды и сточных вод промышленных предприятий. Фильтрующие адсорбенты на основе природных глин широко используются в пищевой промышленности для очистки пищевых растворов, сиропов, соков и растительных масел.
Теория мономолекулярной адсорбции основывается на следующих положениях: 1) Адсорбция является локализованной (происходит на адсорбционных центрах). 2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными. 3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул. 4) Процесс адсорбции находится в динамическом равновесии с процессом десорбции.
Полимолекулярная адсорбция - поглощение вещества в пределах нескольких слоев адсорбата. В большинстве случаев реальная поверхность твердого тела не вполне однородна энергетически; адсорбция, как правило, не является строго локализованной; адсорбированные молекулы практически всегда взаимодействуют между собой; наконец, стехиометрия может нарушаться, вследствие чего адсорбция не будет ограничена образованием одного слоя. Поэтому реальные изотермы адсорбции всегда отклоняются от изотермы Ленгмюра. Еще самим Ленгмюром было показано, что если адсорбционные центры считать энергетически неоднородными, то суммарная адсорбция на всех центрах будет выражена следующим уравнением:
где i - количество групп одинаковых центров. Брунауэр, Эммет и Теллер отказались от второго допущения Ленгмюра, приводящего к мономолекулярной адсорбции. Для случая, когда температура адсорбтива ниже критической (то есть, это еще пар) они разработали теорию полимолекулярной адсорбции. При адсорбции газов часто наблюдается капиллярная конденсация( конденсация пара в жидкость в узких порах адсорбента) и хемосорбция (химическое взаимодействие адсорбата с адсорбентом). Хемосорбция обычно связана с образованием новой фазы. Она может происходить на поверхности адсорбента, если продукт реакции покрывает твёрдое тело плёнкой, непроницаемой для газа. Хемосорбция может распространяться и на всю массу твёрдого тела. Примером такой хемосорбции служит поглощение оксида углерода оксидом кальция. Скорость хемосорбции зависит от скорости химической реакции и от скорости диффузии газов через продукты реакции. Хемосорбция обычно необратима. Хемосорбция лежит в основе взаимодействия ферментов с субстратами; с неё начинается также процесс образования комплекса антиген-антитело.
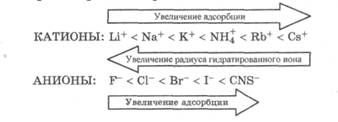
5. Адсорбция сильных электролитов: эквивалентная, избирательная, ионообменная. Иониты и их применение в медицине. В зависимости от природы адсорбента процессы адсорбции ионов электролитов подразделяются на ионную адсорбцию и ионообменную адсорбцию. Ионная адсорбция заключается в адсорбции ионов из растворов электролитов на поверхности твердых веществ, кристаллическая решетка которых состоит из ионов или полярных молекул, т. е. на полярных адсорбентах. Ионная адсорбция имеет ряд характерных особенностей. 1. При ионной адсорбции на поверхности адсорбента вследствие адсорбции ионов, называемых потенциалопределяющими, возникает определенный заряд, который притягивает из раствора противоположно заряженные ионы - противоионы; в результате на границе раздела фаз возникает двойной электрический слой. 2. Скорость ионной адсорбции меньше скорости молекулярной адсорбции, так как скорость диффузии сольватированных ионов меньше скорости диффузии молекул и, кроме того, адсорбции ионов предшествует более медленный, чем у молекул, процесс десольватации. 3. Ионная адсорбция не всегда обратима, так как она может сопровождаться хемосорбцией, приводящей, например, к образованию малорастворимого вещества. 4. Адсорбируемость ионов определяется величиной их заряда, радиуса и степенью сольватации. Если заряд ионов одинаков, то лучше адсорбируются ионы с большим радиусом (меньше их сольватация). По величине адсорбции ионы располагаются в лиотропные ряды:
Многозарядные ионы адсорбируются лучше однозарядных, исключение составляет катион водорода:
Адсорбция сильных электролитов бывает: эквивалентная, избирательная и ионообменная. 1) Эквивалентная – катионы и анионы адсорбируются в эквивалентных количествах. 2) Избирательная. Она подчиняется правилу Панета – Фаянса:
|
|||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 2832; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.67.237 (0.015 с.) |

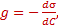
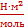
 ,
,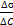 – поверхностная активность,
– поверхностная активность,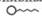 , в котором "головка" соответствует полярной группе, а "хвост" — гидрофобному фрагменту. При наличии в растворе вещества, молекулы которого дифильны, будет происходить их эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз (рис. 26.5). Полярный фрагмент всегда обращен к полярной (гидрофильной) фазе - к воде, силикагелю, а неполярный фрагмент - к неполярной (гидрофобной) фазе - активированному углю, маслу.
, в котором "головка" соответствует полярной группе, а "хвост" — гидрофобному фрагменту. При наличии в растворе вещества, молекулы которого дифильны, будет происходить их эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз (рис. 26.5). Полярный фрагмент всегда обращен к полярной (гидрофильной) фазе - к воде, силикагелю, а неполярный фрагмент - к неполярной (гидрофобной) фазе - активированному углю, маслу.